题目内容
2.某学生拟用图1所示装置模拟工业制取并收集ClO2,用NaClO3和草酸(H2C2O4)恒温在60℃时反应制得.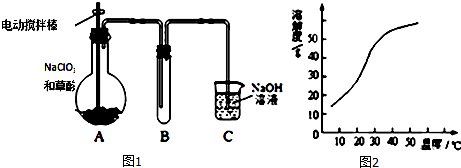
(1)反应过程中需要对A容器进行加热,加热的方式为水浴加热;加热需要的玻璃仪器除酒精灯外,还有温度计、大烧杯;
(2)反应后在装置C中可得亚氯酸钠(NaClO2)溶液.已知NaClO2饱和溶液在温度低于38℃时,析出的晶体是NaClO2•3H2O,在温度高于38℃时析出的是NaClO2.根据图2所示NaClO2的溶解度曲线,请完成从NaClO2溶液中制得NaClO2的操作步骤:①蒸发浓缩;②冷却(大于38℃)结晶;③洗涤;④干燥.
(3)目前我国已成功研制出利用NaClO2制取二氧化氯的新方法,将Cl2通入到NaClO2溶液中,现制取270kg二氧化氯,需要亚氯酸钠的质量是362kg.
(4)ClO2和Cl2均能将电镀废水中的剧毒CN-氧化为无毒物质,自身被还原为Cl-.处理含CN-相同量的电镀废水,所需Cl2的物质的量是ClO2的2.5倍.
分析 (1)工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得ClO2、K2CO3和CO2,所以反应要用水浴加热;
(2)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法;
(3)根据反应方程式进行计算;
(4)处理含CN-相同量的电镀废水时,每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,故为2.5倍.
解答 解:(1)工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得ClO2、K2CO3和CO2,所以反应要用水浴加热,为了准确测量水浴的温度需要用温度计,另外水浴装置中除酒精灯外,还需要用大烧杯,
故答案为:水浴加热;温度计、大烧杯;
(2)从溶液中制取溶质,一般采用蒸发浓缩、冷却(大于38℃)结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2•3H2O,趁热过滤;用38℃~60℃热水洗涤;低于60℃干燥;
故答案为:蒸发浓缩; 冷却(大于38℃)结晶;
(3)设亚氯酸钠的质量是为xkg,
根据反应 2NaClO2+Cl2=2NaCl+2ClO2
181 135
x 270kg
所以x=$\frac{270kg×181}{135}$=362
故答案为:362kg;
(4)处理含CN-相同量的电镀废水时,每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,则所需Cl2的物质的量是ClO2的2.5倍,
故答案为:2.5.
点评 本题考查化学工艺流程,涉及氧化还原反应电子转移计算,化学实验基本方法(除杂)等相关知识,题目难度中等,注意把握物质的分离、提纯操作方法,题目难度不大,该部分内容是高考的热点,掌握基础是关键.

| A. | Na | B. | Na2O2 | C. | Na2O | D. | Na2CO3 |
 在密闭容器中,将起始浓度均为2mol/L的CO和H2O混合加热到400℃,发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:
在密闭容器中,将起始浓度均为2mol/L的CO和H2O混合加热到400℃,发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:(1)平衡时CO的转化率为75%;该反应在该温度时的化学平衡常数为9.
(2)在相同的条件下,如果H2O和CO的起始浓度变为4mol/L,则CO的转化率为75%.
(3)800℃时,该反应的平衡常数为1,则该反应的△H< 0(填>,<,=)
(4)改变起始条件,在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生上述反应,CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)=0.03mol/(L•min)
(5)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表:
t℃时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | 0.104 |
| 6 | 0.096 | 0.266 | 0.104 |
②反应在4min~5min问,平衡向逆方向移动,可能的原因是D(单选),
表中5min~6min之间数值发生变化,可能的原因是A(单选).
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度.
| 族 周期 | IA | 0 | ||||||
| 1 | a | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | |
| 2 | b | c | d | |||||
| 3 | e | f | ||||||
(2)e的元素符号是Na;
(3)b、c、d、三种元素的非金属性逐渐增强(填减弱或增强);
(4)a元素和f元素形成化合物的电子式为
 .
. Cr2O72-+H2O?2CrO42-+2H+ K2Cr2O7为橙色,K2 CrO4为黄色.取两只试管各加入5ml0.1mol/L K2Cr2O7溶液,然后按如表步骤操作.
| 编号 | 1 | 2 |
| 步骤 | 滴加3~10滴浓硫酸 | 滴加10~20滴6mol/LNaOH溶液 |
(2)1号实验的现象是:溶液橙色加深;结论是:增大生成物浓度平衡向逆方向移动;
(3)2号实验的现象是:溶液黄色加深;结论是:减小生成物浓度平衡向正方向移动.

 氢化铝锂是有机合成中常见的强还原剂,合成LiAlH4的一种方法如下:
氢化铝锂是有机合成中常见的强还原剂,合成LiAlH4的一种方法如下: Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题:
Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题: