题目内容
(1)已知工业上生产H2的过程中有如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)
在一定条件下的密闭容器中,该反应达到化学平衡状态.请回答:
①若增大H2O(g)的浓度,则CO的转化率 (填“增大”或“减小”).
②若升高温度能使化学平衡向正反应方向移动,则正反应是 (填“放热”或“吸热”)反应.
③在某温度时,该反应10min达到平衡,且有如下数据:
则上表中x= ,该温度下平衡常数K的数值是 .
(2)某化学实验小组的同学模仿工业上用离子交换膜法制烧碱的方法,设计出下图装置,通过电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾.
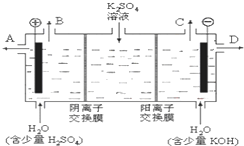
①该电解槽的阳极反应式为 .
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”) 导出.
③通电开始后,阴极附近溶液pH会增大,请简述原因 .
在一定条件下的密闭容器中,该反应达到化学平衡状态.请回答:
①若增大H2O(g)的浓度,则CO的转化率
②若升高温度能使化学平衡向正反应方向移动,则正反应是
③在某温度时,该反应10min达到平衡,且有如下数据:
| 浓度 物质 | CO | H2O | CO2 | H2 |
| 起始浓度/(mol?L-1) | 2.0 | x | 0 | 0 |
| 平衡浓度/(mol?L-1) | 0.4 | 6.4 | 1.6 | 1.6 |
(2)某化学实验小组的同学模仿工业上用离子交换膜法制烧碱的方法,设计出下图装置,通过电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾.

①该电解槽的阳极反应式为
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”)
③通电开始后,阴极附近溶液pH会增大,请简述原因
考点:化学平衡的影响因素,化学平衡常数的含义,电解原理
专题:基本概念与基本理论
分析:(1)①增大反应物浓度,平衡向正反应方向移动;
②升高温度,平衡向吸热反应方向移动;
③根据二氧化碳的平衡浓度计算参加反应的水的浓度,参加反应的浓度加上平衡浓度等于水的初始浓度,根据K=
计算平衡常数;
(2)①阳极上氢氧根离子放电生成氧气;
②阴极上氢离子放电,同时阴极附近生成氢氧根离子,从而得到KOH;
③阴极上氢离子放电,导致溶液中氢氧根离子浓度增大.
②升高温度,平衡向吸热反应方向移动;
③根据二氧化碳的平衡浓度计算参加反应的水的浓度,参加反应的浓度加上平衡浓度等于水的初始浓度,根据K=
| c(CO2).c(H2) |
| c(CO).c(H2O) |
(2)①阳极上氢氧根离子放电生成氧气;
②阴极上氢离子放电,同时阴极附近生成氢氧根离子,从而得到KOH;
③阴极上氢离子放电,导致溶液中氢氧根离子浓度增大.
解答:
解:(1)①增大反应物水蒸气的浓度,平衡向正反应方向移动,则CO的转化率增大,故答案为:增大;
②升高温度平衡向吸热反应方向移动,若升高温度能使化学平衡向正反应方向移动,说明正反应是吸热反应,故答案为:吸热;
③根据方程式中二氧化碳和水蒸气的关系知,参加反应的水的物质的量等于生成二氧化碳的物质的量,所以参加反应的c(H2O)=c(CO2)=1.6mol/L,则水蒸气的初始浓度=(6.4+1.6)mol/L=8.0mol/L,
K=
=
=1,故答案为:8.0;1;
(2)①阳极上氢氧根离子放电生成氧气,电极反应式为:4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
②阴极上氢离子放电生成氢气,水电离生成氢离子和氢氧根离子,导致阴极附近氢氧根离子浓度增大,钾离子通过质子交换膜移向阴极,氢氧化钾存在于溶液中,密度大于气体,所以KOH溶液充D口排出,故答案为:D;
③阴极上氢离子放电,促进水电离,导致溶液中氢氧根离子浓度增大,溶液的碱性增强,pH变大,故答案为:阴极H+放电,促进水的电离,OH-浓度增大.
②升高温度平衡向吸热反应方向移动,若升高温度能使化学平衡向正反应方向移动,说明正反应是吸热反应,故答案为:吸热;
③根据方程式中二氧化碳和水蒸气的关系知,参加反应的水的物质的量等于生成二氧化碳的物质的量,所以参加反应的c(H2O)=c(CO2)=1.6mol/L,则水蒸气的初始浓度=(6.4+1.6)mol/L=8.0mol/L,
K=
| c(CO2).c(H2) |
| c(CO).c(H2O) |
| 1.6×1.6 |
| 0.4×6.4 |
(2)①阳极上氢氧根离子放电生成氧气,电极反应式为:4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
②阴极上氢离子放电生成氢气,水电离生成氢离子和氢氧根离子,导致阴极附近氢氧根离子浓度增大,钾离子通过质子交换膜移向阴极,氢氧化钾存在于溶液中,密度大于气体,所以KOH溶液充D口排出,故答案为:D;
③阴极上氢离子放电,促进水电离,导致溶液中氢氧根离子浓度增大,溶液的碱性增强,pH变大,故答案为:阴极H+放电,促进水的电离,OH-浓度增大.
点评:本题考查了化学平衡和电解原理,涉及温度和浓度对平衡的影响、化学平衡常数的计算、电解原理等知识点,根据温度和和反应热的关系、浓度与反应移动方向的关系、电解池中各个电极上发生的电极反应来分析解答,化学平衡移动方向的判断及电解原理是高考热点,要熟练掌握,灵活运用基础知识解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
绿色化学追求减少化工生产对环境造成的污染,下列物质可以称为绿色氧化剂的是( )
| A、H202 |
| B、KMnO4 |
| C、HNO3 |
| D、Ca(ClO)2 |
新房子装修使用的木工板、胶合板等材料常会释放出一种具刺激性气味的气体,该气体是( )
| A、甲烷 | B、氨气 |
| C、甲醛 | D、二氧化硫 |
 现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高.
现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高.


 已知A是应用最广泛、用量最大的一种金属单质,B是黑色固体,C是气体单质,在一定条件下有下列转化关系:
已知A是应用最广泛、用量最大的一种金属单质,B是黑色固体,C是气体单质,在一定条件下有下列转化关系: