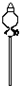题目内容
 已知元素aA、bB、cC、dD、eE的原子结构示意图分别为:
已知元素aA、bB、cC、dD、eE的原子结构示意图分别为:请回答下列问题:
(1)属于同周期的元素是
(2)金属性最强的元素是
(3)上述元素中最高价氧化物对应的水化物碱性最强的是
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:由元素原子结构示意图,可知A为Al、B为Cl、C为Na、D为Br、E为F.
(1)同周期元素原子具有相同电子层数,同主族元素原子最外层电子数相同;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱;
(3)元素金属性越强,其最高价氧化物对应的水化物碱性越强.
(1)同周期元素原子具有相同电子层数,同主族元素原子最外层电子数相同;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱;
(3)元素金属性越强,其最高价氧化物对应的水化物碱性越强.
解答:
解:由元素原子结构示意图,可知A为Al、B为Cl、C为Na、D为Br、E为F.
(1)同周期元素原子具有相同电子层数,故Na、Al、Cl同周期,同主族元素原子最外层电子数相同,所以F、Cl、Br同主族,故答案为:Na、Al、Cl;F、Cl、Br;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,所以Na的金属性最强,F的非金属性最强,故答案为:Na;F;
(3)同周期自左而右金属性减弱,故金属性Na>Al.元素金属性越强,其最高价氧化物对应的水化物碱性越强,故NaOH的碱性最强,故答案为:NaOH.
(1)同周期元素原子具有相同电子层数,故Na、Al、Cl同周期,同主族元素原子最外层电子数相同,所以F、Cl、Br同主族,故答案为:Na、Al、Cl;F、Cl、Br;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,所以Na的金属性最强,F的非金属性最强,故答案为:Na;F;
(3)同周期自左而右金属性减弱,故金属性Na>Al.元素金属性越强,其最高价氧化物对应的水化物碱性越强,故NaOH的碱性最强,故答案为:NaOH.
点评:本题考查结构与位置关系、元素周期律等,比较基础,关键是弄清原子结构示意图与元素在周期表中的位置关系,注意对元素周期律的理解.

练习册系列答案
相关题目
将1mol/L H2SO4溶液50mL与质量分数为10%的NaOH溶液50g混合均匀后,滴入甲基橙指示剂,此时溶液的颜色是( )
| A、蓝色 | B、黄色 | C、红色 | D、橙色 |