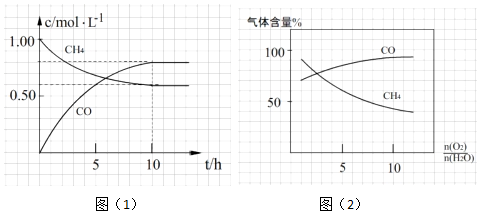
题目内容
12.下列实验操作及现象描述不合理的是( )| A. | 0.01mol/L 标准盐酸溶液滴定未知浓度氨水,可以使用甲基橙作指示剂 | |
| B. | 向0.01mol/L酸性高锰酸钾溶液中滴加适量0.1mol/L草酸溶液,振荡,一段时间后溶液突然变为无色 | |
| C. | 向1mol/L KI溶液中逐滴滴加适量0.1mol/L稀硫酸和淀粉溶液,振荡,一段时间后无明显现象 | |
| D. | 向1mL 0.1mol/L MgCl2溶液的试管中滴加1~2滴2mol/L NaOH溶液,振荡后出现白色沉淀,再滴加2滴0.1mol/L FeCl3溶液,沉淀变为红褐色 |
分析 A.根据指示剂的变色范围与酸碱中和后的越接近越好,且变色明显(终点变为红色);
B.当二者恰好反应时,高锰酸钾消失,溶液变为无色;
C.酸性条件下碘离子易被氧化成碘单质,碘单质遇到淀粉显示蓝色;
D.难溶的氢氧化镁能够转化成更难溶氢氧化铁沉淀.
解答 解:A.甲基橙的变色范围是3.1-4.4,用酸滴定碱时,甲基橙加在碱里,达到滴定终点时,溶液颜色由黄变红,易于观察,故A正确;
B.向0.01mol/L酸性高锰酸钾溶液中滴加适量0.1mol/L草酸溶液,振荡,高锰酸钾溶液为紫红色,当二者恰好反应时溶液变为无色,所以一段时间后溶液突然变为无色,故B正确;
C.向1mol/L KI溶液中逐滴滴加适量0.1mol/L稀硫酸和淀粉溶液,振荡,由于碘离子被氧化成碘单质,则一段时间后溶液呈蓝色,故C错误;
D.向1mL 0.1mol/L MgCl2溶液的试管中滴加1~2滴2mol/L NaOH溶液,振荡后出现氢氧化镁白色沉淀,再滴加2滴0.1mol/L FeCl3溶液,氢氧化镁沉淀变为红褐色的氢氧化铁沉淀,实现了沉淀的转化,故D正确;
故选C.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及中和滴定、氧化还原反应、难溶物转化等知识,明确化学实验基本操作方法为解答关键,试题有利于提高学生的灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.下列实验方案中,不能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热.冷却后,取出上层水溶液,用稀HNO3酸化,加入AgNO3溶液,观察是否产生淡黄色沉淀 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| D | 验证AgI的溶解度小于AgCl | 将NaI浓溶液加入AgCl悬浊液中,振荡,可观察到沉淀由白色变为黄色 |
| A. | A | B. | B | C. | C | D. | D |
3.以下实验操作方法正确的是( )
| A. | 除去Cl2中的HCl:将混合气体通过AgNO3溶液 | |
| B. | 除去C2H6中的C2H4:将混合气体通过酸性KMnO4溶液 | |
| C. | 检验CO2中是否混有HCl:将气体通入饱和NaHCO3溶液 | |
| D. | 检验Cl2中是否混有空气:将装有气体的试管倒置在NaOH溶液中 |
20.元素A-D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题.
(1)写出四种元素的元素符号:ANa、BN、CCl、DMg.
(2)A原子核外有4种能量不同的电子;写出D离子的核外电子排布式1s22s22p6.
(3)D和C形成的化合物R属于离子晶体;R的熔点高于四氯化碳,理由是R是离子晶体,固态四氟化碳是分子晶体
(4)A的金属性比D强,写出能证明该结论的一个事实金属钠能从熔融的氯化镁中置换出金属镁.
(5)设计一个简单实验,说明一水合氨是弱碱测定氯化铵溶液的pH值,测得其pH<7.
| 元素 | A | B | C | D |
| 性质 结构 信息 | 单质银白色,燃烧时火焰呈黄色. | 其单质是空气的主要成分,化学性质非常稳定. | 原子的3p亚层上有5个电子. | +2价阳离子的核外电子排布与氖原子相同. |
(2)A原子核外有4种能量不同的电子;写出D离子的核外电子排布式1s22s22p6.
(3)D和C形成的化合物R属于离子晶体;R的熔点高于四氯化碳,理由是R是离子晶体,固态四氟化碳是分子晶体
(4)A的金属性比D强,写出能证明该结论的一个事实金属钠能从熔融的氯化镁中置换出金属镁.
(5)设计一个简单实验,说明一水合氨是弱碱测定氯化铵溶液的pH值,测得其pH<7.
7.下列各组有机物的同分异构体种数相同的一组是( )
| A. | C4H10与C3H6 | B. | C5H12与C2H6O | C. | C2H2Cl4与CH2Cl2 | D. | CH2O与C2H4O2 |
4.向1L的密闭容器中加入1mol X、0.3mol Z和一定量的Y三种气体.一定条件下发生反应,各物质的浓度随时间变化如图一所示.图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.下列说法不正确的是( )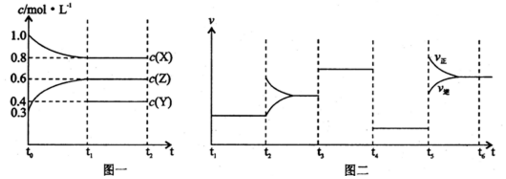

| A. | Y的起始物质的量为0.5 mol | |
| B. | 该反应的化学方程式为:2X(g)+Y(g)?3Z(g)△H<0 | |
| C. | 若t0=0,t1=10 s,则t0~t1阶段的平均反应速率为v(Z)=0.03 mol/(L•s) | |
| D. | 反应物X的转化率t6点比t3点高 |
1.如图甲是利用一种微生物将废水中的尿素(H2NCONH2)的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是( )
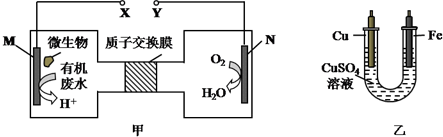

| A. | 乙装置中溶液颜色会变浅 | |
| B. | 铁电极应与Y相连接 | |
| C. | M电极反应式:H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+ | |
| D. | 当N电极消耗0.25mol气体时,则铜电极质量减少16g |