题目内容
下列事实不能说明元素的金属性或非金属性相对强弱的是( )
| 序号 | 事实 | 推论 |
| A | 与冷水反应,Na比Mg剧烈 | 金属性:Na>Mg |
| B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca>Mg |
| C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S>C |
| D | t℃时,Br2+H2?2HBr K=5.6×107 I2+H2?2HI K=43 |
非金属性:Br>I |
| A、A | B、B | C、C | D、D |
考点:金属在元素周期表中的位置及其性质递变的规律,非金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题
分析:A.金属性越强,与水反应越剧烈;
B.金属性越强,对应的最高价氧化物的水化物碱性越强;
C.SO2与NaHCO3溶液反应生成CO2,可知酸性亚硫酸大于碳酸;
D.K越大,说明生成的气态氢化物越稳定.
B.金属性越强,对应的最高价氧化物的水化物碱性越强;
C.SO2与NaHCO3溶液反应生成CO2,可知酸性亚硫酸大于碳酸;
D.K越大,说明生成的气态氢化物越稳定.
解答:
解:A.N、Mg位于同周期,金属性Na>Mg,则与冷水反应,Na比Mg剧烈,故A正确;
B.Ca、Mg位于同主族,金属性Ca>Mg,对应的最高价氧化物的水化物碱性为Ca(OH)2强于Mg(OH)2,故B正确;
C.SO2与NaHCO3溶液反应生成CO2,可知酸性亚硫酸大于碳酸,亚硫酸不是最高价氧化物的水化物,则不能以此比较非金属性,故C错误;
D.K越大,说明生成的气态氢化物越稳定,则稳定性为HBr>HI,则非金属性为Br>I,故D正确;
故选C.
B.Ca、Mg位于同主族,金属性Ca>Mg,对应的最高价氧化物的水化物碱性为Ca(OH)2强于Mg(OH)2,故B正确;
C.SO2与NaHCO3溶液反应生成CO2,可知酸性亚硫酸大于碳酸,亚硫酸不是最高价氧化物的水化物,则不能以此比较非金属性,故C错误;
D.K越大,说明生成的气态氢化物越稳定,则稳定性为HBr>HI,则非金属性为Br>I,故D正确;
故选C.
点评:本题考查金属性及非金属性的比较,为高频考点,把握元素的位置、元素周期律及比较方法为解答的关键,注意归纳金属性、非金属性比较方法,题目难度不大,选项C为易错点.

练习册系列答案
相关题目
下列溶液中,各组离子能大量共存的是( )
| A、pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
| B、在强酸溶液中:Na+、ClO-、Cl-、Ba2+ |
| C、在含有大量Fe3+的溶液中:NH4+、Cl-、Na+、SCN- |
| D、由水电离的c(H+)=10-13mol?L-1的溶液中:Na+、Cl-、K+、SO42- |
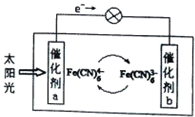 一种太阳能电池的工作原理示意图如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
一种太阳能电池的工作原理示意图如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )| A、K+移向催化剂b |
| B、催化剂a表面发生反应:Fe(CN)64--e-═Fe(CN)63- |
| C、Fe(CN)63-在催化剂b表面被氧化 |
| D、电解质溶液中Fe(CN)63-和Fe(CN)64-浓度基本保持不变 |
下列说法正确的是( )
| A、蛋白质及其水解产物都具有两性 |
| B、淀粉和油脂都是可水解的高分子化合物 |
| C、鸡蛋清溶液中加入饱和Na2SO4溶液有沉淀生成是因为蛋白质变性 |
| D、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
下列涉及有机物的说法正确的是( )
| A、甲酸的性质与乙酸类似,都不能被酸性高锰酸钾溶液氧化 |
| B、石油和植物油都是混合物,且属于不同类的有机物 |
| C、乙醇转化为乙醛的反应有碳氧双键生成,属于消去反应 |
| D、纤维素、蔗糖、葡萄糖和淀粉酶在一定条件下都可发生水解反应 |

 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: