题目内容
下列有关说法错误的是( )
| A、为保护海轮的船壳,常在船壳上镶入锌块 |
| B、纯碱溶于热水中,去污效果增强,说明纯碱的水解反应是吸热反应 |
| C、已知工业合成氨气△H<0,达平衡后,升高温度,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 |
| D、Na2O2与水反应中,氧化剂还原剂都是Na2O2,且1mol Na2O2参加反应有1mol电子转移 |
考点:金属的电化学腐蚀与防护,化学平衡的影响因素,盐类水解的应用,钠的重要化合物
专题:基本概念与基本理论
分析:A.锌比铁活泼,锌为负极,可防止铁被腐蚀;
B.盐类的水解为吸热反应,加热促进水解;
C.升高温度,正逆反应速率都增大;
D.Na2O2中O元素化合价为-1价,自身发生氧化还原反应,根据化合价变化解答.
B.盐类的水解为吸热反应,加热促进水解;
C.升高温度,正逆反应速率都增大;
D.Na2O2中O元素化合价为-1价,自身发生氧化还原反应,根据化合价变化解答.
解答:
解:A.锌比铁活泼,锌为负极,可防止铁被腐蚀,为牺牲阳极的阴极保护法,故A正确;
B.盐类的水解为吸热反应,加热促进水解,溶液碱性增起,有利于油脂的水解,故B正确;
C.升高温度,正逆反应速率都增大,故C错误;
D.Na2O2中O元素化合价为-1价,自身发生氧化还原反应,1mol Na2O2参加反应有1mol电子转移,故D正确.
故选C.
B.盐类的水解为吸热反应,加热促进水解,溶液碱性增起,有利于油脂的水解,故B正确;
C.升高温度,正逆反应速率都增大,故C错误;
D.Na2O2中O元素化合价为-1价,自身发生氧化还原反应,1mol Na2O2参加反应有1mol电子转移,故D正确.
故选C.
点评:本题考查较为综合,涉及金属的腐蚀、盐类的水解、反应速率的影响以及氧化还原反应等知识,为高考常见题型,侧重于学生的分析能力和基础知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
两支试管中分别加入足量的等物质的量浓度的稀硫酸和氢氧化钠溶液,然后分别加入等质量的金属铝,充分反应,放出气体的体积比为( )
| A、2:3 | B、3:2 |
| C、1:3 | D、1:1 |
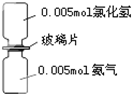 如图是氨气与氯化氢反应的装置.抽走玻璃片充分反应,反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( )
如图是氨气与氯化氢反应的装置.抽走玻璃片充分反应,反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( )| A、气体反应物的总体积为0.224L |
| B、产物中所含的N-H键个数为0.02NA |
| C、生成物中含有0.005NA个分子 |
| D、加1L水溶解后所得溶液中阳离子浓度为0.005mol?L-1 |
下列有关物质性质的应用正确的是( )
| A、石英坩埚耐高温,可用来加热熔化NaOH固体 |
| B、浓硫酸有脱水性,可用作干燥剂 |
| C、二氧化硫有漂白性,可大量用于加工食品使食品漂白 |
| D、医用酒精能使蛋白质变性,可用来消毒杀菌 |
实验是化学研究的基础,下列关于各实验装置的叙述正确的是( )
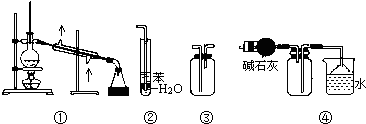
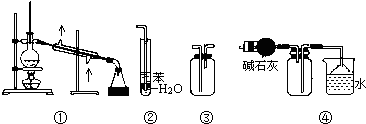
| A、装置①常用于分离互相溶解且沸点相差10℃以上的液态混合物 |
| B、装置②可用于吸收NH3或HCl气体,并防止到吸 |
| C、装置③可用于收集H2、CO2、Cl2、NH3等气体 |
| D、装置④可用于干燥、收集氨气,若将碱石灰改成五氧化二磷,可用于干燥、收集氯化氢 |
21世纪化学的最新定义为“化学是一门创造新物质的科学”.下列有关说法不正确的是( )
| A、利用人工光合成反应,探究将二氧化碳转化为碳氢化合物作燃料,属于低碳技术 |
| B、开发安全、高效、低毒及低残留的新型农药 |
| C、加大稀土资源的开采和出口,制造更多高新产品,保证经济快速发展 |
| D、制备物质时探究化学反应中高选择性、转化率和原子利用率,属于“绿色”的生产工艺 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、0.1mol/L的NaOH溶液:K+、AlO2-、SO42-、CO32- | ||
| B、0.1mol/LFeCl3溶液:K+、NH4+、I-、SCN- | ||
| C、0.1mol/L的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | ||
D、
|
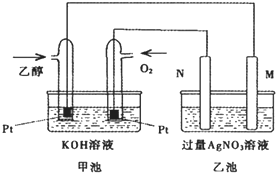 如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: