题目内容
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物:
CH4 (g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-570kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则CH4 (g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H= .
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g)+6H2(g)
CH3OCH3(g)+3H2O(g)
已知在压强为a MPa下,该反应在不同温度、不同投料比时,CO2的转化率见图:
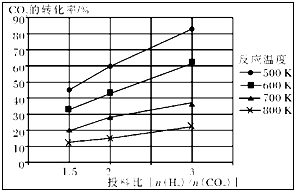
①此反应为 (填“放热”、“吸热”);若温度不变,提高投料比[n(H2)/n(CO2)],则K将 (填“增大”、“减小”或“不变”).
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池正极的电极反应式: .
③在a MPa和一定温度下,将6mol H2和2mol CO2在2L密闭容器中混合,当该反应达到平衡时,测得平衡混合气中CH3OCH3的体积分数约为16.7%(即
),此时CO2的转化率是多少?(在答题卡的方框内写出计算过程,计算结果保留2位有效数字)
④在a MPa和500K下,将10mol H2和5mol CO2在2L密闭容器中混合,5min达到平衡,请在答题卡的坐标图中画出H2浓度变化图.
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物:
CH4 (g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-570kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则CH4 (g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g)+6H2(g)
| 催化剂 |
已知在压强为a MPa下,该反应在不同温度、不同投料比时,CO2的转化率见图:

①此反应为
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池正极的电极反应式:
③在a MPa和一定温度下,将6mol H2和2mol CO2在2L密闭容器中混合,当该反应达到平衡时,测得平衡混合气中CH3OCH3的体积分数约为16.7%(即
| 1 |
| 6 |
④在a MPa和500K下,将10mol H2和5mol CO2在2L密闭容器中混合,5min达到平衡,请在答题卡的坐标图中画出H2浓度变化图.
考点:热化学方程式,化学电源新型电池,转化率随温度、压强的变化曲线
专题:基本概念与基本理论
分析:(1)根据盖斯定律用已知的反应来求未知反应的焓变;
(2)①根据温度和二氧化碳的转化率以及平衡移动之间的关系来回答;平衡常数和温度有关,和物质的浓度之间没有联系;
②甲醚作为燃料电池的原料.甲醚在负极失电子发生氧化反应,氧气在正极上发生还原反应,依据电极书写方法写出电极反应;
③根据平衡状态的判断知识以及三行式来计算物质的转化率;
④根据三行式计算氢气的平衡浓度画图即可.
(2)①根据温度和二氧化碳的转化率以及平衡移动之间的关系来回答;平衡常数和温度有关,和物质的浓度之间没有联系;
②甲醚作为燃料电池的原料.甲醚在负极失电子发生氧化反应,氧气在正极上发生还原反应,依据电极书写方法写出电极反应;
③根据平衡状态的判断知识以及三行式来计算物质的转化率;
④根据三行式计算氢气的平衡浓度画图即可.
解答:
解:(1)因盖斯定律,不管化学反应是一步完成还是分几步完成,其反应热是相同的.两式相加,可得2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1730 kJ/mol,所以CH4(g)+NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-865 kJ/mol,
故答案为:-865 kJ?mol-1;
(2)①根据图示知道,温度越高,二氧化碳的转化率越小,平衡逆向移动,所以反应是放热的,平衡常数和温度有关,温度不变,K不会改变,
故答案为:放热;不变;
②甲醚作为燃料电池的原料,甲醚在负极失电子发生氧化反应,氧气在正极上发生还原反应,电解质是碱性环境下,电极反应式为:O2+4e-+2H2O═4OH-,
故答案为:O2+4e-+2H2O═4OH-;
③设:CO2的转化率是x,则
2CO2(g)+6H2(g)
CH3OCH3(g)+3H2O(g)
初始浓度:1 3 0 0
变化浓度:x 3x 0.5x 1.5x
平衡浓度:1-x 3-3x 0.5x 1.5x
=
,解得x=0.8,所以CO2的转化率是
×100%=80%.
答:此时CO2的转化率是80%;
④将10mol即5mol/L的H2和5molCO2在2L密闭容器中混合,5min达到平衡,根据a MPa和500K下投料比[n(H2)/n(CO2)]=2时,二氧化碳的转化率是60%.
2CO2(g)+6H2(g)
CH3OCH3(g)+3H2O(g)
初始浓度:2.5 5 0 0
变化浓度:1.5 4.5
平衡浓度:1 0.5
则氢气的浓度从5mol/L变为0.5mol/L,
答:坐标图中画出H2浓度变化图为 .
.
故答案为:-865 kJ?mol-1;
(2)①根据图示知道,温度越高,二氧化碳的转化率越小,平衡逆向移动,所以反应是放热的,平衡常数和温度有关,温度不变,K不会改变,
故答案为:放热;不变;
②甲醚作为燃料电池的原料,甲醚在负极失电子发生氧化反应,氧气在正极上发生还原反应,电解质是碱性环境下,电极反应式为:O2+4e-+2H2O═4OH-,
故答案为:O2+4e-+2H2O═4OH-;
③设:CO2的转化率是x,则
2CO2(g)+6H2(g)
| 催化剂 |
初始浓度:1 3 0 0
变化浓度:x 3x 0.5x 1.5x
平衡浓度:1-x 3-3x 0.5x 1.5x
| 0.5x |
| 1-x+3-3x+0.5x+1.5x |
| 1 |
| 6 |
| 0.8 |
| 1 |
答:此时CO2的转化率是80%;
④将10mol即5mol/L的H2和5molCO2在2L密闭容器中混合,5min达到平衡,根据a MPa和500K下投料比[n(H2)/n(CO2)]=2时,二氧化碳的转化率是60%.
2CO2(g)+6H2(g)
| 催化剂 |
初始浓度:2.5 5 0 0
变化浓度:1.5 4.5
平衡浓度:1 0.5
则氢气的浓度从5mol/L变为0.5mol/L,
答:坐标图中画出H2浓度变化图为
 .
.
点评:本题考查了盖斯定律的应用、影响平衡移动及平衡常数的因素、化学平衡的有关计算、原电池原理;侧重于反应原理的应用的考查,题目难度中等,注意燃料电池中电解质溶液的酸碱性对电极反应的影响.

练习册系列答案
相关题目
下列实验操作或对实验事实的叙述正确的是( )
| A、将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 |
| B、用碱式滴定管量取20.00mL0.1mol/LKMnO4溶液 |
| C、向沸腾的NaOH溶液中滴加FeCl3溶液,制备Fe(OH)3胶体 |
| D、配制FeSO4溶液时,需加入少量铁粉和稀硫酸 |
下列物质中的杂质(括号内为杂质)的检验、除杂的试剂或方法正确的是( )
| 物质及其杂质 | 检验 | 除杂 |
| A.Cl2(HCl) | 湿润的淀粉KI试纸 | 饱和食盐水 |
| B.NaHCO3溶液(Na 2CO3) | Ca(OH)2溶液 | 过量CO2 |
| C.CO2(HCl) | AgNO3溶液(含稀硝酸) | 饱和Na2CO3溶液 |
| D.NO(NO2) | 观察颜色或湿润的淀粉KI试纸 | 水 |
| A、Cl2(HCl) |
| B、NaHCO3溶液(Na 2CO3) |
| C、CO2(HCl) |
| D、NO(NO2) |
向一定量的饱和NaOH溶液中加入少量Na2O2固体,恢复到原来温度时,下列说法中正确的是( )
| A、溶液中的Na+总数增大 |
| B、溶液的碱性增强 |
| C、溶质的质量分数不变 |
| D、溶液的质量不变 |
 准确称取6g铝土矿(含Al2O3,Fe2O3,SiO2)样品,放入盛有100mLH2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/LNaOH溶液,产生沉淀的量与所加NaOH溶液的体积关系如图所示.试求:
准确称取6g铝土矿(含Al2O3,Fe2O3,SiO2)样品,放入盛有100mLH2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/LNaOH溶液,产生沉淀的量与所加NaOH溶液的体积关系如图所示.试求: