题目内容
用下列方法制取氢气,反应速率最大的是( )
| A、0℃下,块状铁与2mol?L-1硫酸溶液反应 |
| B、0℃下,粉末状铁与18.4mol?L-1硫酸溶液反应 |
| C、25℃下,粉末状铁与2mol?L-1硫酸溶液反应 |
| D、25℃下,粉末状铁与18.4mol?L-1硫酸溶液反应 |
考点:化学反应速率的影响因素
专题:
分析:题中涉及影响反应速率的因素有温度、浓度和固体的表面积大小,一般来说,温度越高、浓度越大,固体的表面积越大,则反应速率越大,反之越小,以此解答.
解答:
解:B、D选项中为浓硫酸,在常温下铁发生钝化反应,难以生成氢气,A与C相比较,C温度较高,固体表面积较大,则反应速率较大.
故选C.
故选C.
点评:本题考查化学反应速率的影响因素,侧重于学生的分析能力的考查,为高考高频考点,注意把握影响反应速率的因素,注重相关知识的学习与积累,难度不大.

练习册系列答案
相关题目
持续的低温大雪使我国北方地区的“暖宝宝”成为紧俏商品.暖宝宝采用的是铁的“氧化放热”原理,使其发生原电池反应,铁粉在原电池中充当( )
| A、负极 | B、正极 | C、阴极 | D、阳极 |
下列反应的离子方程式错误的是( )
| A、次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
| B、过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| C、硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+=Fe3++4H2O |
| D、硝酸铁溶液中加过量氨水:Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+ |
 反应2X(g)+Y(g)?2Z△H<0 在不同温度和压强下,产物Z的物质的量与反应时间的关系如图所示.则下列叙述正确的是( )
反应2X(g)+Y(g)?2Z△H<0 在不同温度和压强下,产物Z的物质的量与反应时间的关系如图所示.则下列叙述正确的是( )| A、T1>T2,P1<P2 |
| B、T1>T2,P1>P2 |
| C、T1<T2,P1>P2 |
| D、T1<T2,P1<P2 |
短周期中有X、Y、Z三种元素,Z可分别与X、Y组成化合物XZ2、ZY2,这三种元素原子的核外电子数之和为30,每个XZ2分子的核外电子总数为38,由此可推知X、Y、Z依次为( )
| A、Na、F、O |
| B、N、O、P |
| C、C、F、O |
| D、C、O、S |
下列化学反应方程式或离子方程式书写正确的是( )
| A、乙烯制溴乙烷:CH2CH2+Br2→CH2BrCH2Br | |||
B、乙醇催化氧化:2CH3CH2OH+O2
| |||
C、苯与氢气加成: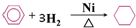 | |||
| D、从海带中提取碘:H2O2+2I-+2H+=I2+2H2O |


