题目内容
16.下列叙述正确的是( )| A. | Na2O2可作供氧剂,而Na2O不行 | |
| B. | 钠在常温下不容易被氧化 | |
| C. | Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 | |
| D. | 钠在氯气中燃烧,生成白色的烟雾 |
分析 A.过氧化钠与水、二氧化碳反应生成产物都有氧气,氧化钠与水、二氧化碳反应不会产生氧气;
B.钠性质活泼,极易被氧气、水蒸气氧化;
C.碱性氧化物与水反应只生成碱;
D.钠在氯气中生成固体氯化钠.
解答 解:A.过氧化钠与水、二氧化碳反应生成产物都有氧气,氧化钠与水、二氧化碳反应不会产生氧气,所以过氧化钠可以做供氧剂,故A正确;
B.钠性质活泼,极易被氧气、水蒸气氧化,故B错误;
C.过氧化钠与水反应生成氢氧化钠和氧气,不符合碱性氧化物概念,不属于碱性氧化物,故C错误;
D.钠在氯气中生成固体氯化钠,所以只能看到白烟,故D错误;
故选:A.
点评 本题考查了元素化合物知识,熟悉钠及其化合物的性质是解题关键,注意碱性氧化物的概念,题目难度不大.

练习册系列答案
相关题目
6.某无色溶液中可能含有I-、Na+、Fe2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液组成的判断正确的是( )
①肯定不含I-;
②肯定不含Fe2+;
③肯定含有SO32-;
④可能含有I-.
①肯定不含I-;
②肯定不含Fe2+;
③肯定含有SO32-;
④可能含有I-.
| A. | ①③ | B. | ①②③ | C. | ③④ | D. | ②③④ |
7.人民币一硬币有明亮的银白色的光泽且密度较大,小明同学认为一元硬币中含有铁,他这一想法属于科学探究过程的( )
| A. | 提出问题 | B. | 获得结论 | C. | 猜想 | D. | 反思 |
11.与己二酸( )含有相同官能团的同分异构体有( )
)含有相同官能团的同分异构体有( )
 )含有相同官能团的同分异构体有( )
)含有相同官能团的同分异构体有( )| A. | 6 种 | B. | 7 种 | C. | 8 种 | D. | 9 种 |
1.下列各组物质相互混合后,既有气体生成又有白色沉淀生成的是( )
①金属钠投入到FeCl3溶液中②过量的NaOH溶液和铝铵矾[NH4Al(SO4)2]溶液混合 ③少量电石(CaC2)投入到过量的NaHCO3溶液中④Na2O2投入到FeCl2溶液中.
①金属钠投入到FeCl3溶液中②过量的NaOH溶液和铝铵矾[NH4Al(SO4)2]溶液混合 ③少量电石(CaC2)投入到过量的NaHCO3溶液中④Na2O2投入到FeCl2溶液中.
| A. | ②④ | B. | ③ | C. | ②③ | D. | ①④ |
8.在温度t1和t2下(t2>t1),卤素单质X2(g)和H2反应生成HX的平衡常数如下表:
仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,得到的结论是( )
a.HX的生成反应是放热反应
b.在相同条件下,平衡时X2的转化率逐渐降低
c.X2与H2反应的剧烈程度逐渐减弱
d.HX的还原性逐渐减弱
e.HX的稳定性逐渐减弱.
| 化学方程式 | F2+H2?2HF | H2+Cl2?2HCl | H2+Br2(g)?2HBr | H2+I2(g)?2HI(g) |
| 平衡常数K(t1) | 1.8×1036 | 9.7×1012 | 5.6×107 | 43 |
| 平衡常数K(t2) | 1.9×1032 | 4.2×1011 | 9.3×106 | 34 |
a.HX的生成反应是放热反应
b.在相同条件下,平衡时X2的转化率逐渐降低
c.X2与H2反应的剧烈程度逐渐减弱
d.HX的还原性逐渐减弱
e.HX的稳定性逐渐减弱.
| A. | 只有ab | B. | 只有abe | C. | 只有abce | D. | abcde |
10.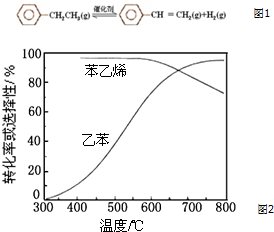 乙苯催化脱氢制苯乙烯反应如图1:
乙苯催化脱氢制苯乙烯反应如图1:
(1)已知:
反应的△H=+124kJ•mol-1,X=412kJ•mol-1.
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{α{\;}^{2}}{(1-α{\;}^{2})}p$(用α等符号表示),在平衡体系中充入氖气反应速率将减小(填“增大”“减小”“不变”).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图1:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利于CO2资源利用
(5)产物中另一种物质常用做燃料电池的材料,若电解质为熔融碳酸盐,其负极电极反应式为H2-2e-+CO32-=H2O+CO2↑.
 乙苯催化脱氢制苯乙烯反应如图1:
乙苯催化脱氢制苯乙烯反应如图1:(1)已知:
| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | X | 348 | 612 | 436 |
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{α{\;}^{2}}{(1-α{\;}^{2})}p$(用α等符号表示),在平衡体系中充入氖气反应速率将减小(填“增大”“减小”“不变”).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图1:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利于CO2资源利用
(5)产物中另一种物质常用做燃料电池的材料,若电解质为熔融碳酸盐,其负极电极反应式为H2-2e-+CO32-=H2O+CO2↑.
