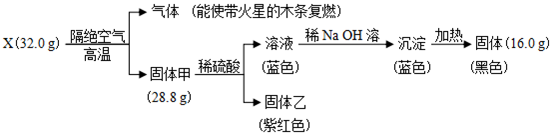
题目内容
19.能与氢氧化钠溶液反应的原子晶体且是单质的是( )| A. | 铝 | B. | 金刚石 | C. | 硅 | D. | 二氧化硅 |
分析 A、铝是金属晶体单质;
B、金刚石是原子晶体,但与氢氧化钠不反应;
C、硅是原子晶体,硅与氢氧化钠反应生成硅酸钠和氢气;
D、二氧化硅是化合物;
解答 解:A、铝是金属晶体单质,而不是原子晶体,故A不选;
B、金刚石是原子晶体,但与氢氧化钠不反应,故B不选;
C、硅是原子晶体,硅与氢氧化钠反应生成硅酸钠和氢气,所以硅符合,故C选;
D、二氧化硅是化合物,而不是单质,故D不选;
故选C.
点评 本题考查硅、铝的化学性质,把握硅不同于其他非金属的特性为解答本题的关键,注意Al与强碱溶液反应生成氢气,但是金属晶体,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.羰基硫(COS)常用作粮食熏蒸剂,制取反应为CO(g)+H2S(g)?COS(g)+H2(g),△H<0.在恒容的密闭容器中不同条件下发生反应并达到平衡,数据如表.下列说法错误的是( )
| 实验 | 温度/℃ | 起始时 | 平衡时 | |||
| n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
| 1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
| 2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
| 3 | b | 20.0 | 20.0 | 0 | 0 | 16.0 |
| A. | 实验1反应开始到平衡整个过程中转移的电子的物质的量为6mol | |
| B. | 实验2达平衡时,a>7.0 | |
| C. | 实验3温度b>150 | |
| D. | 实验3 CO平衡转化率比实验1小 |
10.标准状况下,将2.24LCO2气体通入150mL1.00mol•L-1 NaOH溶液中,充分反应后溶液中c(CO32-)与c(HCO3-)的比值为(不考虑CO32-、HCO3-的水解)( )
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 1:3 |
7.下列气体不能用排水法收集而要用向上排空气法收集的是( )
| A. | NO2 | B. | O2 | C. | NH3 | D. | NO |
14.下列四种物质的结构图中,小黑球代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表价键,示例:如 ),下列说法正确的是( )
),下列说法正确的是( )
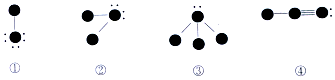
 ),下列说法正确的是( )
),下列说法正确的是( )
| A. | 四种物质中摩尔质量最大的是③ | B. | ①与③反应生成一种离子化合物 | ||
| C. | ④中含有非极性共价健 | D. | 该四种化合物涉及6种元素 |
11.从防止污染和减少用酸量的角度分析,下列制取Cu(NO3)2的方法中最好的是( )
| A. | Cu$\stackrel{浓硝酸}{→}$Cu(NO3)2 | B. | Cu$\stackrel{稀硝酸}{→}$Cu(NO3)2 | ||
| C. | Cu$→_{△}^{O_{2}}$CuO$\stackrel{硝酸}{→}$Cu(NO3)2 | D. | Cu$→_{△}^{浓硫酸}$CuSO4$\stackrel{硝酸钡}{→}$Cu(NO3)2 |