题目内容
11.下列说法正确的是( )| A. | 25℃时,向水中加入少量固体NaHSO4,c(H+)增大,Kw不变 | |
| B. | 向0.1 mol•L-1CH3COOH溶液中加入少量的CH3COONa晶体,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$减小 | |
| C. | 常温下,向BaCO3饱和溶液中加入Na2CO3固体,c(Ba2+)减小,BaCO3的Ksp减小 | |
| D. | 一定条件下,将一定浓度的CH3COONa溶液加水稀释,溶液中所有离子的浓度都减小 |
分析 A.25℃时,向水中加入少量固体NaHSO4,c(H+)增大,温度不变Kw不变;
B.向0.1 mol•L-1CH3COOH溶液中加入少量的CH3COONa晶体,醋酸根离子浓度增大,醋酸电离平衡逆向进行,醋酸增大,氢离子浓度减小;
C.常温下,向BaCO3饱和溶液中存在沉淀溶解平衡,温度不变溶度积常数不变;
D.一定条件下,将一定浓度的CH3COONa溶液加水稀释,平衡状态下离子浓度减小,溶液中存在离子积常数.
解答 解:A.25℃时,向水中加入少量固体NaHSO4,电离出的氢离子抑制水的电离,c(H+)增大,但温度不变Kw不变,故A正确;
B.向0.1 mol•L-1CH3COOH溶液中加入少量的CH3COONa晶体,醋酸根离子浓度增大,醋酸电离平衡逆向进行,氢离子浓度减小$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Ka}{c({H}^{+})}$,比值增大,故B错误;
C.常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3(s)?Ba2+(aq)+CO32-(aq),平衡逆向进行,c(Ba2+)减小,BaCO3的Ksp不变,故C错误;
D.一定条件下,将一定浓度的CH3COONa溶液加水稀释,溶液中平衡状态下离子的浓度都减小,但溶液中存在离子积常数,氢氧根离子浓度减小,氢离子浓度增大,故D错误;
故选A.
点评 本题考查了水电离平衡影响因素、盐类水解平衡影响因素、溶度积常数和电离平衡常数的分析应用、掌握基础是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).
实验测得不同温度下的平衡数据列于表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总液度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:K=1.6×10-8mol3/L3.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加 (填“增加”,“减少”或“不变”).
④氨基甲酸铵分解反应的焓变△H>0(填“>”、“=”或“<”),熵变△S>0(填“>”、“=”或“<”).
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示.
计算25.0℃时,0~6min 氨基甲酸铵水解反应的平均速率0.05mol/(L•min).
| A. |  蒸拌原料 蒸拌原料 | B. |  淀粉发酵 淀粉发酵 | C. |  用水浸淋 | D. |  放置陈酿 放置陈酿 |
| A. | 用糯米酿制甜酒 | |
| B. | 石油气的液化与煤的液化 | |
| C. | 书籍中的纸张由白色慢慢变成黄色 | |
| D. | 含有吸水性的植物纤维的干燥剂吸水胀包 |
| A. | 2A(l)+B(l)═2C(g)△H | B. | 2A(g)+B(g)═2C(g)△H | C. | 2A(l)+B(l)═2C(l)△H | D. | 2A(g)+B(g)═2C(l)△H |
| 选项 | 实验 | 现象 | 结论 |
| A | 用pH试纸检测:0.1mol•L-1Na2SO3溶液、0.1mol•L-1NaHSO3溶液 | Na2SO3溶液的pH 约为10;NaHSO3 溶液的pH约为5 | HSO3-结合H+的能力比SO32-强 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | Na2CO3溶液中存在水解平衡 |
| C | 注射器中吸入NO2,封堵针尖处,将注射器体积压缩为原来的一半 | 气体颜色比起始时浅 | 加压后,NO2转变为无色的N2O4 |
| D | 饱和BaSO4悬浊液中加入饱和Na2CO3溶液,振荡,然后过滤、洗涤,向所得固体中加入盐酸 | 沉淀部分溶解且有 气体产生 | Ksp(BaSO4)> Ksp(BaCO3) |
| A. | A | B. | B | C. | C | D. | D |
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| A(g) | B(g) | C(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
| A. | 该反应的正反应为△H<0 | |
| B. | 207℃,K=4 | |
| C. | 达到平衡时,容器Ⅰ中的A体积分数与容器Ⅱ中的相同 | |
| D. | 容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的短 |
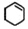 )为原料合成,路线如下(部分反应条件省略):
)为原料合成,路线如下(部分反应条件省略):



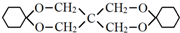 .
. .
.
 ;
; ;
; .
. .
. .
. 和
和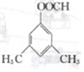 .
. . 仿照上述流程,设计以苯、乙醛为有机原料(无机试剂任选)制备某药物中间体
. 仿照上述流程,设计以苯、乙醛为有机原料(无机试剂任选)制备某药物中间体 的合成路线:
的合成路线: .
.