题目内容
用6.5g的锌与足量硫酸反应,能得到多少升的氢气(标况下)?用所得的氢气与氧化铜反应,制得的铜的质量是多少?
考点:化学方程式的有关计算
专题:计算题
分析:根据方程式Zn+H2SO4=ZnSO4+H2↑计算生成氢气的体积;根据CuO+H2
Cu+H2O计算Cu的质量.
| ||
解答:
解:设生成标况下氢气的体积为V,则:
Zn+H2SO4=ZnSO4+H2↑
65g 22.4L
6.5g V
V=
=2.24L
氢气的物质的量=
=0.1mol,
设可以制得Cu为m,则:
CuO+H2
Cu+H2O
1mol 64g
0.1mol m
m=
=6.4g
答:能得到2.24升的氢气,用所得的氢气与氧化铜反应,制得的铜的质量是6.4g.
Zn+H2SO4=ZnSO4+H2↑
65g 22.4L
6.5g V
V=
| 6.5g×22.4L |
| 65g |
氢气的物质的量=
| 2.24L |
| 22.4L/mol |
设可以制得Cu为m,则:
CuO+H2
| ||
1mol 64g
0.1mol m
m=
| 0.1mol×64g |
| 1mol |
答:能得到2.24升的氢气,用所得的氢气与氧化铜反应,制得的铜的质量是6.4g.
点评:本题考查化学方程式的有关计算,比较基础,注意根据方程式计算,利用电子转移守恒计算更为简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
在2A+B?3C+5D的反应中,下列措施一定能加快反应速率的是( )
| A、增加A的量 | B、增大压强 |
| C、升高温度 | D、减少C的量 |
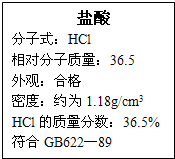 右图为某市售盐酸试剂瓶标签上的部分数据,通过计算回答:
右图为某市售盐酸试剂瓶标签上的部分数据,通过计算回答: )有关的化学方程式:
)有关的化学方程式: