题目内容
16.将2molSO2和1molO2分别置于相同体积的甲乙两密闭容器中发生反应2SO2(g)+O2(g)?2SO3(g),并达到平衡.在这过程中,甲容器保持恒温恒容,乙容器保持恒温恒压,达到平衡时,下列说法正确的是( )| A. | 达到平衡所需的时间为:甲>乙 | B. | 甲的转化率>乙的转化率 | ||
| C. | 混合气体中SO3的含量为:甲>乙 | D. | 气体的总物质的量:甲<乙 |
分析 在相同温度下发生反应2SO2+O2?2SO3,该反应为气体物质的量减小的反应,若甲容器保持体积不变,乙容器保持压强不变,则随着反应的进行,甲的压强逐渐减小,达平衡时,乙容器压强大于甲容器压强,根据压强对平衡移动的影响分析.
解答 解:A、达平衡时,乙容器压强大于甲容器压强,压强越大反应速率快,故A正确;
B、达平衡时,乙容器压强大于甲容器压强,压强增大平衡正向移动,乙转化率大,故B错误;
C、乙转化率大,混合气体中生成物多,故C错误;
D、达平衡时,乙容器压强大于甲容器压强,压强增大平衡气体体积减小的方向移动,故D错误;
故选A.
点评 本题考查化学平衡的影响因素,题目难度中等,注意根据反应方程式的特点把握压强对平衡移动的影响.

练习册系列答案
相关题目
5.要防止水体污染,改善水质,最根本的措施是( )
| A. | 控制工业废水的排放 | B. | 对河水进行消毒处理 | ||
| C. | 控制农田排水 | D. | 减少用水量 |
4.下列指定化学用语正确的是( )
| A. | NaHCO3水解的离子方程式:HCO3-+H2O?CO32-+H2O- | |
| B. | Ca(OH)2的电离方程式:Ca(OH)2?Ca2++2OH- | |
| C. | AgCl 的沉淀溶解平衡表达式:AgCl(s)?Ag+(aq)+CI“(aq) | |
| D. | Na2S 水解的离子方程式:S2-+2H2O?H2S+2OH- |
11.80℃时,NO2(g)+SO2(g)?SO3(g)+NO(g).该温度下,在甲、乙、丙三个恒容密闭容器中,投入NO2和SO2,起始浓度如表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列判断正确的是( )
| 起始浓度 | 甲 | 乙 | 丙 |
| C(NO2)/mol•L-1 | 0.10 | 0.20 | 0.20 |
| C(SO2)/mol•L-1 | 0.10 | 0.10 | 0.20 |
| A. | 平衡时,丙中SO2的转化率大于50% | |
| B. | 当反应平衡时,乙中c(NO2)是甲中的2倍 | |
| C. | 温度升至90℃,上述反应平衡常数为$\frac{25}{26}$,则Z正反应为吸热反应 | |
| D. | 其他条件不变,若起始时向容器乙中充入0.10mol•L-lNO2和0.20mol•L-lSO2,达到平衡时c(NO)与原平衡相同 |
1.下列各组物质之间通过一步就能实现如图所示转化的是( )
| 物质编号 | 物质转化关系 | a | b | c | d |
| ① | 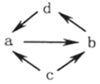 | NO | NO2 | N2 | HNO3 |
| ② | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
| ③ | SiO2 | Na2SiO3 | Si | H2SiO3 | |
| ④ | SO2 | SO3 | S | H2SO4 |
| A. | ①② | B. | ②③ | C. | ②④ | D. | ①③ |
5.下列说法正确的是( )
| A. | 加热胆矾失去结晶水,得到白色无水硫酸铜,这一过程叫风化 | |
| B. | 家用石碱(主要成分是Na2CO3•10H2O )久置后,由块状变成粉末状,这一变化是风化的结果 | |
| C. | 含有水蒸气的气体通过固体NaOH 时,固体表面出现水珠,这是固体氢氧化钠潮解的原故 | |
| D. | 从冰箱取出物品,表面很快出现水珠,这种现象叫潮解 |
6.化学在生产和日常生活中有着重要的作用.下列有关说法正确的是( )
| A. | “地沟油”经过加工处理后,可以用来制肥皂 | |
| B. | 二氧化硫有漂白性,大量用作棉,麻、纸张和食品的漂白 | |
| C. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 | |
| D. | PM2.5颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶 |