题目内容
17.2015年8月15日,天津港发生爆炸,现场发现有氰化钠(NaCN),NaCN易溶于水,有剧毒,易造成水污染.氰化钠遇水或酸均会产生HCN,挥发到空气中更容易对人体造成伤害,在现场处置中,有一条措施是组织当地企业喷洒双氧水,HCN与双氧水反应产生两种无毒气体.请回答下列问题: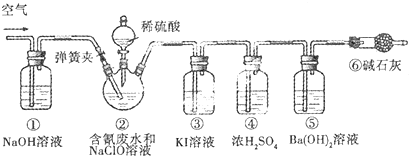
(1)写出NaCN的电子式

(2)写出氰化氢与双氧水反应的化学方程式2HCN+5H2O2=N2+2CO2+6H2O
(3)利用下图所示装置进行含氰废水处理百分率的测定实验.将CN-的浓度为0.2000mol/L的含氰废水100mL与100mL NaClO溶液(过量)置于装置②三颈烧瓶中充分反应,打开分液漏斗活塞,滴入l00mL稀H2SO4,关闭活塞.反应结束后,打开弹簧夹,鼓入空气一段时间,关闭弹簧夹.已知装置②中发生的主要反应依次为:
CN-+C1O-═CNO-+C1-;2CNO-+2H++3ClO-═N2+2CO2↑+3C1-+H2O
①鼓入空气的目的是使装置中残留的二氧化碳全部进入装置⑤完全吸收;
②实验中观察到三颈烧瓶上方有黄绿色气体,则装置③的现象是溶液变为褐色
③装置⑥的作用是排除空气中二氧化碳对实验的干扰
④为了计算该实验装置②中含氰废水被处理的百分率,实验中需要测定装置装置⑤ 反应前后的质量(从装置①到⑥中选择,填装置序号).若已知该装置反应前后质量变化为0.8g,则实验中测得CN-被处理的百分率为90.9%
(4)处理含氰废水还可用石墨作阳极,铁板作阴极,在碱性废水中加入氯化钠进行电解,当氯化钠投加量较少时,则以氯化钠为导电介质,主要依靠阳极的氧化作用,使CN-在阳极上放电,当氯化钠投加量较多时,则利用Cl-在阳极上放电的产物将CN-氧化,以达到治理的作用.请用离子方程式表示氯化钠较多时阳极区的反应2Cl--2e-=Cl2↑,5Cl2+2CN-+12OH-=2CO32-+N2↑+10Cl-+6H2O.
分析 处理含氰废水,并测定含氰废水的处理百分率实验的原理是:利用CN-+ClO-═CNO+Cl-;2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O,通过测定⑤的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率.根据装置中试剂的性质推测装置的位置;装置①吸收空气中二氧化碳,排除空气中的二氧化碳对实验的干扰,装置②产生二氧化碳,装置③的作用是吸收装置②中可能产生的Cl2,防止对装置⑤实验数据的测定产生干扰,装置④对产生的二氧化碳进行干燥,根据关系式计算含氰废水处理百分率,装置⑥的作用是排除空气中二氧化碳对实验的干扰,排除空气中二氧化碳对实验的干扰.
(1)NaCN属于离子化合物,钠离子直接用离子符号表示,阴离子需要标出所带电荷及最外层电子;
(2)氰化氢与双氧水反应生成两种无毒气体为氮气和二氧化碳,依据原子守恒书写化学方程式;
(3)①反应结束后,缓缓通入空气,可将生成的二氧化碳全部被吸收;
②实验中观察到三颈烧瓶上方有黄绿色气体,说明生成了氯气,则装置③的现象是氯气氧化碘离子生成碘单质,溶液变为褐色;
③实验中应排除空气中二氧化碳的干扰;
④实验的原理是利用CN-+ClO-═CNO+Cl-;2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O,
通过测定碱石灰的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,;
(4)用石墨作阳极,铁板作阴极,在碱性废水中加入氯化钠进行电解,当氯化钠投加量较少时,则以氯化钠为导电介质,主要依靠阳极的氧化作用,使CN-在阳极上放电,当氯化钠投加量较多时,则利用Cl-在阳极上放电的产物将CN-氧化,氯化钠较多时阳极区发生的电极反应为氯离子失电子生成氯气,氯气在碱溶液中将CN-氧化生成碳酸盐和氮气,氯气被还原为氯离子,结合电荷守恒、原子守恒配平书写离子方程式.
解答 解:(1)NaCN为离子化合物,电子式为 ,故答案为:
,故答案为: ;
;
(2)氰化氢与双氧水反应生成两种无毒气体为氮气和二氧化碳,反应的化学方程式为:2HCN+5H2O2=N2+2CO2+6H2O,
故答案为:2HCN+5H2O2=N2+2CO2+6H2O;
(3)①反应后装置中残留二氧化碳,应继续通过将净化的空气,将装置内的残留的二氧化碳全部进入装置⑤,以减少实验误差,
故答案为:使装置中残留的二氧化碳全部进入装置⑤完全吸收;
②实验中观察到三颈烧瓶上方有黄绿色气体,说明生成了氯气,则装置③的现象是氯气氧化碘离子生成碘单质,Cl2+2I-=I2+2Cl-,碘单质溶于水溶液变为褐色,
故答案为:溶液变为褐色;
③实验中应排除空气中二氧化碳的干扰,防止对装置⑤实验数据的测定产生干扰,装置①和⑥的作用是排除空气中二氧化碳对实验的干扰,
故答案为:防止空气中的CO2和H2O进入装置⑤,产生误差;
④实验的原理是利用CN-+ClO-═CNO+Cl-;2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O,通过测定装置⑤的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,若已知该装置反应前后质量变化为0.8g,物质的量=$\frac{0.8g}{44g/mol}$=$\frac{0.2}{11}$mol,将CN-的浓度为0.2000mol/L的含氰废水100mL与100mL NaClO溶液(过量)置于装置②三颈烧瓶中充分反应,CN-物质的量=0.2000mol/L×0.100L=0.02mol,
CN-~CNO~CO2
实验中测得CN-被处理的百分率=$\frac{\frac{0.2}{11}}{0.02}$×100%=90.9%,
故答案为:装置⑤;90.9%;
(4)用石墨作阳极,铁板作阴极,在碱性废水中加入氯化钠进行电解,当氯化钠投加量较少时,则以氯化钠为导电介质,主要依靠阳极的氧化作用,使CN-在阳极上放电,当氯化钠投加量较多时,则利用Cl-在阳极上放电的产物将CN-氧化,氯化钠较多时阳极区发生的电极反应为氯离子失电子生成氯气,氯气在碱溶液中将CN-氧化生成碳酸盐和氮气,氯气被还原为氯离子,2Cl--2e-=Cl2↑,结合电荷守恒、原子守恒配平书写离子方程式为:5Cl2+2CN-+12OH-=2CO32-+N2↑+10Cl-+6H2O,
故答案为:2Cl--2e-=Cl2↑,5Cl2+2CN-+12OH-=2CO32-+N2↑+10Cl-+6H2O.
点评 本题综合考查物质含量的测定的实验设计,以氯气的性质为载体考查化学实验设计和评价问题,题目难度中等,注意把握实验原理和实验方法.

| A. | 新制的氯水保存在棕色广口瓶中,并放在阴凉处 | |
| B. | 溴水存放在带玻璃塞的无色试剂瓶中 | |
| C. | 烧碱溶液放在带玻璃塞的磨口试剂瓶中 | |
| D. | 金属钠保存在煤油中 |
| A. | v(A)=0.5mol•L-1•mim-1 | B. | v(B)=0.3mol•L-1•mim-1 | ||
| C. | v(C)=0.8mol•L-1•mim-1 | D. | v(D)=0.1mol•L-1•s-1 |
①2-乙基戊烷?②1,2-二氯丁烷?③2,2-二甲基-4-己醇 ④3,4-二甲基戊烷 ⑤二溴乙烷 ⑥1-甲基丙醇
⑦2-甲基-3-戊炔 ⑧2-甲基-1,3-丁二烯.
| A. | ①⑤⑥ | B. | ②③④ | C. | ②⑧ | D. | ③⑥⑦ |
| A. | 生物柴油具有良好的燃料性能,属于烃类,安全、环保、可再生 | |
| B. | 油脂是人类维持生命活动所需能量的主要来源 | |
| C. | PM2.5是指空气中氮氧化物和硫氧化物含量之和 | |
| D. | 登高山时防晒是为了防止强紫外线引起皮肤蛋白质被灼伤变性 |
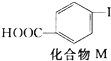 +CH2═CH2$\stackrel{一定条件}{→}$
+CH2═CH2$\stackrel{一定条件}{→}$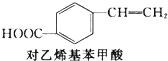 +HI
+HI下列关于化合物M和对乙烯基苯甲酸的说法正确的是( )
| A. | 对乙烯基苯甲酸的分子式为C9H10O2 | |
| B. | 对乙烯基苯甲酸的同分异构体共有三种 | |
| C. | 对乙烯基苯甲酸既属于羧酸,又属于烯烃 | |
| D. | 二者均可发生取代反应和加成反应 |
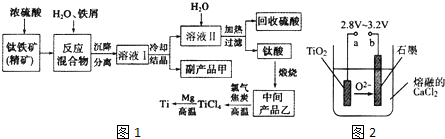
请回答下列问题:
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C$\frac{\underline{\;高温\;}}{\;}$2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为FeTiO3;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为FeTiO3+2H2SO4$\frac{\underline{\;高温\;}}{\;}$TiOSO4+FeSO4+2H2O.
(2)上述生产流程中加入铁屑的目的是防止Fe2+被氧化为Fe3+.此时溶液中含有 Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如表所示.
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-14 | 1.0×10-29 | 1.8×10-11 |
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是隔绝空气.除去所得金属钛中少量的金属镁可用的试剂是稀盐酸.
(4)在800~1000℃时电解TiO2也可制得海绵钛,装置如图2所示.图中b是电源的正极,阴极的电极反应式为TiO2 +4e-=Ti+2O2-.
| 物质变化 | 能量关系 | |
| A | 将充满NO2的针筒置于热水中,气体颜色变深 | 1molN2O4(g)的能量>2molNO2(g)的能量 |
| B | 将NaOH溶液与HCl溶液混合 | 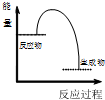 |
| C | 1g气态SiH4在空气中燃烧,生成SiO2 (s)与液态水,放热44.6kJ | SiH4(g)+2O2(g)→SiO2(s)+2H2O(l)+44.6kJ |
| D | 合成氨:N2(g)+3H2(g)?2NH3(g)+92.4kJ | 反应物的总键能>生成物的总键能 |
| A. | A | B. | B | C. | C | D. | D |
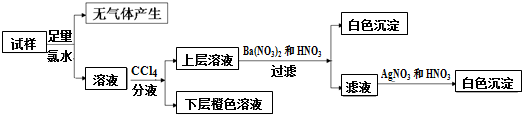
| A. | 若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响 | |
| B. | 无法确定原溶液中是否存在Cl- | |
| C. | 肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定 | |
| D. | 肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证 |