题目内容
20.加热10.0g碳酸钠和碳酸氢钠的混合物到质量不再变化为止,剩余固体的质量为8.45g.(1)求混合物中碳酸钠的质量分数;
(2)如果将这10.0g碳酸钠和碳酸氢钠的混合物投入到足量的稀盐酸中,得到的气体在标准状况下的体积为多少?
分析 (1)加热碳酸钠和碳酸氢钠的混合物时,碳酸钠不分解,碳酸氢钠不稳定,加热时分解生成碳酸钠、二氧化碳和水,利用差量法,根据2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O计算碳酸氢钠的质量,进而计算碳酸钠的质量分数;
(2)稀盐酸足量,所有的C原子都转化成二氧化碳,据此计算出二氧化碳的物质的量,再根据V=nVm计算出二氧化碳的体积.
解答 解:(1)加热碳酸钠和碳酸氢钠的混合物时,碳酸钠不分解,碳酸氢钠不稳定,加热时分解生成碳酸钠、二氧化碳和水,发生反应为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,则固体质量减少的原因是由于碳酸氢钠分解的缘故,设混合物中碳酸氢钠的质量为m,利用差量法计算,则
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O△m
2×84g 62g
m 10.0g-8.45g=1.55g
m=$\frac{2×84g×1.55g}{62g}$=4.2g,
所以混合物中碳酸钠的质量为:10.0g-4.2g=5.8g,
混合物中碳酸钠的质量分数为:$\frac{5.8g}{10.0g}$=58%;
答:混合物中碳酸钠的质量分数为58%;
(2)4.2g碳酸氢钠的物质的量为:n(NaHCO3)=$\frac{4.2g}{84g/mol}$=0.05mol,
5.8g碳酸钠的物质的量为:n(Na2CO3)=$\frac{5.8g}{106g/mol}$≈0.0547mol,
将这10.0g碳酸钠和碳酸氢钠的混合物投入到足量的稀盐酸中,混合物中所有C原子都转化成了二氧化碳,则完全反应后生成二氧化碳的物质的量为:0.05mol+0.0547mol=0.1047mol,标准状况下生成的二氧化碳的体积为:22.4L/mol×0.1047mol≈2.35L,
答:将10.0g碳酸钠和碳酸氢钠的混合物投入到足量的稀盐酸生成标准状况下二氧化碳的体积为2.35L.
点评 本题考查混合物的计算,题目难度中等,明确发生反应的实质为解答关键,注意根据碳酸氢钠不稳定的性质利用差量法计算,试题培养了学生的分析能力及化学计算能力.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案| A. | 生石灰、白磷、胆矾、纯碱分别属于氧化物、单质、纯净物、盐 | |
| B. | 按树状分类法,物质可分为纯净物和化合物 | |
| C. | NaCl溶液、KClO3、BaSO4都是电解质 | |
| D. | 按分散质粒子的大小,可以把分散系分为溶液、胶体和浊液,其中胶体和溶液的本质区别在于胶体能发生丁达尔效应 |
| A. | 与电源正极相连的是电解池的阴极 | B. | 与电源负极相连的是电解池的阴极 | ||
| C. | 在电解池的阳极发生的是氧化反应 | D. | 若用铁做阴极,则铁不会被氧化 |
| A. | 溶于水得到相对应的碱 | B. | 它对应的水合物是可溶于性强碱 | ||
| C. | 它与强酸溶液反应只生成盐和水 | D. | 它是金属氧化物 |
| A. | NH3+HCl═NH4Cl | B. | H2S+Na2S═2NaHS | ||
| C. | 2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 | D. | CO2+NaOH═NaHCO3 |
(2)已知:2NO2(g)═N2O4(g)△H1 2NO2(g)═N2O4(l)△H2
下列能量变化示意图中,正确的是(选填字母)A.
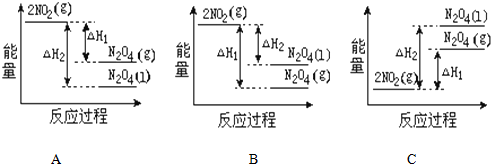
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2 599kJ•mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变(列出简单的计算式):+226.7kJ•mol-1.
(4)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体(结构简式为CH3OH). 已知某些化学键的键能数据如表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
| A. | 为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液进行酸化 | |
| B. | 实验室配制FeCl3溶液时,先将FeCl3溶于浓盐酸再加水稀释 | |
| C. | 从海带灰中提取碘时,为了使I-既能完全转化为I2,又对环境无影响,可选H2O2作氧化剂 | |
| D. | 制备硫酸亚铁铵晶体,在蒸发皿中蒸发浓缩溶液时,不能将溶液全部蒸干 |