题目内容
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、c(H+)=1.0×10-12mol?L-1的溶液:K+、Mg2+、CH3COO-、Br- |
| B、甲基橙呈红色的溶液:NH4+、Ba2+、NO3-、Cl- |
| C、与铝反应产生大量氢气的溶液Na+、K+、CO32-、NO3- |
| D、含1.0mol?L-1 KNO3的溶液Cl-、SO42-、H+、Fe2+ |
考点:离子共存问题
专题:离子反应专题
分析:A.c(H+)=1.0×10-12mol?L-1的溶液,溶液显碱性;
B.甲基橙呈红色的溶液,溶液显酸性;
C.与铝反应产生大量氢气的溶液,为酸或强碱溶液;
D.Fe2+、NO3-、H+发生氧化还原反应.
B.甲基橙呈红色的溶液,溶液显酸性;
C.与铝反应产生大量氢气的溶液,为酸或强碱溶液;
D.Fe2+、NO3-、H+发生氧化还原反应.
解答:
解:A.c(H+)=1.0×10-12mol?L-1的溶液,溶液显碱性,不能大量存在Mg2+,故A错误;
B.甲基橙呈红色的溶液,溶液显酸性,该组离子之间不反应,可大量共存,故B正确;
C.与铝反应产生大量氢气的溶液,为酸或强碱溶液,酸溶液中不能大量存在CO32-,且Al、NO3-、H+发生氧化还原反应不生成氢气,故C错误;
D.Fe2+、NO3-、H+发生氧化还原反应,不能大量共存,故D错误;
故选B.
B.甲基橙呈红色的溶液,溶液显酸性,该组离子之间不反应,可大量共存,故B正确;
C.与铝反应产生大量氢气的溶液,为酸或强碱溶液,酸溶液中不能大量存在CO32-,且Al、NO3-、H+发生氧化还原反应不生成氢气,故C错误;
D.Fe2+、NO3-、H+发生氧化还原反应,不能大量共存,故D错误;
故选B.
点评:本题考查离子的共存,为高频考点,把握离子之间的反应及习题信息的抽取为解答的关键,侧重氧化还原反应及复分解反应的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
设NA代表阿佛加德罗常数,下列说法正确的是( )
| A、22.4LCO和CO2的混合气体中所含的碳原子数一定是NA |
| B、含1mol HCl的盐酸溶液与足量Fe反应,Fe所失去的电子总数为2NA |
| C、常温常压下,32g O2和32g O3所含氧原子数都是2NA |
| D、标准状况下,11.2L H2O含有0.5NA分子 |
以NA表示阿佛加德罗常数,下列说法中正确的是( )
| A、53g碳酸钠中含NA个CO32- |
| B、0.1molOH-含NA个电子 |
| C、1.8gD2O中含NA个中子 |
| D、11.2L氧气中含NA个氧原子 |
用下列有关实验装置进行相应实验,能达到实验目的是( )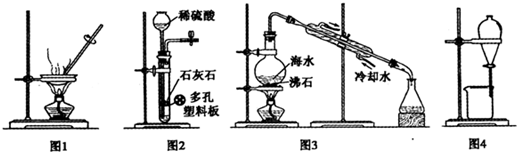

| A、用图1装置蒸干CuCl2饱和溶液制备CuCl2晶体 |
| B、用图2装置制取二氧化碳气体 |
| C、用图3装置蒸馏海水制取少量淡水 |
| D、用图4装置分离乙醇与乙酸乙酯的混合物 |
常温下,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液②NaOH溶液③CH3COONa溶液,下列说法中正确的是(忽略混合前后溶液体积变化)( )
| A、溶液的pH值:②>③>① |
| B、水电离出的c(OH-):③>①=② |
| C、①和③等体积混合后的溶液:c(CH3COOH)+c(CH3COO-)=0.1mol/L |
| D、②和③等体积混合后的溶液:c(Na+)=c(CH3COOH)+c(CH3COO-) |
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是( )
| A、使酚酞变红色的溶液:Na+、Ba2+、I-、Cl- | ||
| B、使甲基橙变红色的溶液:Fe2+、K+、NO3-、SO42- | ||
C、含有0.1 mol?L-1 Fe3+的溶液:Na+、K+、SCN-、NO
| ||
| D、由水电离产生的c(H+)=10-12mol?L-1的溶液:NH4+、SO42-、HCO3-、Cl- |