题目内容
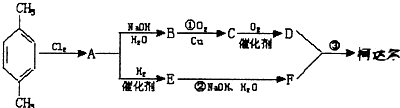
5.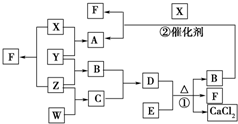 X、Y、Z、W均为气体单质,A、B、C均为无色气体化合物,D、E均为白色固体,F在通常情况下为无色无味的液体,它们有如下的转化关系:
X、Y、Z、W均为气体单质,A、B、C均为无色气体化合物,D、E均为白色固体,F在通常情况下为无色无味的液体,它们有如下的转化关系:请回答下列问题:
(1)Y分子的电子式为
 ,F中的化学键类型为共价键.
,F中的化学键类型为共价键.(2)C的化学式为HCl.
(3)B在F中的反应可以表示为NH3+H2O?NH3•H2O?NH4++OH-.
(4)写出反应①的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
分析 X、Y、Z、W均为气体单质,F在通常情况下为无色无味的液体,X与Z反应得到F,则F为H2O,X、Z分别为H2、O2中的一种,A、B、C均为无色气体化合物,D、E均为白色固体,反应①是实验式制备氨气,则B为NH3,D、E分别为NH4Cl、Ca(OH)2中的一种,B与X反应得到A与F(水),则X为O2,A为NO,Z为H2,X与Y反应得到A,故Y为N2,B(氨气)与C反应得到D,则D为NH4Cl、E为Ca(OH)2、C为HCl,而气体单质W与Z反应得到C,故W为Cl2,据此解答.
解答 解:X、Y、Z、W均为气体单质,F在通常情况下为无色无味的液体,X与Z反应得到F,则F为H2O,X、Z分别为H2、O2中的一种,A、B、C均为无色气体化合物,D、E均为白色固体,反应①是实验式制备氨气,则B为NH3,D、E分别为NH4Cl、Ca(OH)2中的一种,B与X反应得到A与F(水),则X为O2,A为NO,Z为H2,X与Y反应得到A,故Y为N2,B(氨气)与C反应得到D,则D为NH4Cl、E为Ca(OH)2、C为HCl,而气体单质W与Z反应得到C,故W为Cl2.
(1)Y为N2,电子式为 ,F为H2O,含有的化学键类型为共价键,
,F为H2O,含有的化学键类型为共价键,
故答案为: ;共价键;
;共价键;
(2)C的化学式为HCl,故答案为:HCl;
(3)B在F中的反应可以表示为:NH3+H2O?NH3•H2O?NH4++OH-,
故答案为:NH3+H2O?NH3•H2O?NH4++OH-;
(4)反应①的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
点评 本题考查无机物推断,题目涉及物质比较多,熟练掌握气体的实验室制备与常见化学工业、元素化合物性质,题目难度中等.

二甲酸钾的生产工艺流程如下:

(1)以甲酸和碳酸钾为原料生产二甲酸钾,实验测得反应条件对产品回收率的影响如下:
表1 反应温度对产品回收率的影响
| 反应温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 产品回收率(%) | 75.6 | 78.4 | 80.6 | 82.6 | 83.1 | 82.1 | 73.7 |
| 反应物料比 | 2:1 | 3:1 | 4:1 | 5:1 | 6:1 | 7:1 |
| 产品回收率(%) | 0 | 38.4 | 82. 6 | 83.6 | 84.5 | 84.8 |
①写出甲酸和碳酸钾生产二甲酸钾的化学方程式:4HCOOH+K2CO3=2KH(HCOO)2+CO2↑+H2O.
②实际生产二甲酸钾时应选择的最佳反应条件是反应温度应控制在50℃∽60℃,反应物料比应选择4:1.由表1可知反应温度过高,反应回收率反而会降低,其原因可能是温度过高,甲酸易挥发.
(2)测定某弗米产品纯度的实验方法如下:
称取该弗米产品2.5g,将其全部溶解在水中,配制成250mL未知浓度的溶液,取出25.00mL于锥形瓶中,再滴加2~3滴指示剂,用0.10mol•L-1的NaOH溶液滴定至终点,消耗NaOH溶液的体积为18.50mL.
①加入的指示剂是酚酞(选填“甲基橙”、“石蕊”或“酚酞”),用NaOH溶液滴定至终点的现象是溶液由无色恰好变成浅红色且在半分钟内不褪色.
②上述弗米产品中二甲酸钾的质量分数为96.2%.
| A. | NH3、CO、CO2都是极性分子 | |
| B. | CH4、CCl4都是含有极性键的非极性分子 | |
| C. | HF、HCl、HBr、HI的稳定性依次增强 | |
| D. | CS2、H2O、C2H2都是直线形分子 |
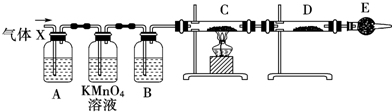
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫.
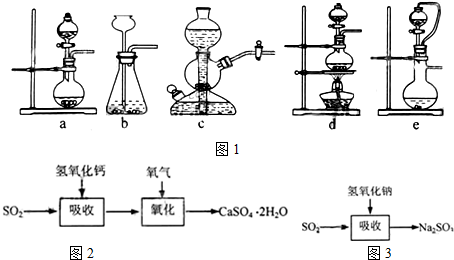
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,图1中可选用的发生装置是ae(填写字母).
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠18.9g(保留一位小数);如果已有40%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠33.1 g (保留一位小数).
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通.石灰-石膏法和碱法是常用的烟气脱硫法.
石灰-石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O.吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO4•2H2O.其流程如2图:碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O.碱法的特点是氢氧化钠碱性强、吸收快、效率高.其流程如图3:
已知:
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示).
| A. | 明矾净水与液氯净水的原理相同 | |
| B. | 将草木灰和硫铵混合施用,肥效更高 | |
| C. | 冬季形成的大雾属于气溶胶 | |
| D. | 电解精炼铜时,同一时间内阴极溶解铜的质量比阳极析出铜的质量小 |
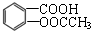 是一种常用的退热、镇痛药物,临床常用于预防心血管疾病.阿斯匹林对肠胃有一定的副作用,患有消化系统疾病的人不宜服用.则下列对此化合物说法不正确的是( )
是一种常用的退热、镇痛药物,临床常用于预防心血管疾病.阿斯匹林对肠胃有一定的副作用,患有消化系统疾病的人不宜服用.则下列对此化合物说法不正确的是( )| A. | 阿斯匹林能与NaHCO3反应,最多能与3mol H2发生加成反应 | |
| B. | 1 mol阿斯匹林与足量的NaOH溶液反应,消耗NaOH最大的物质的量为3 mol | |
| C. | 其苯环上的一氯取代物有两种 | |
| D. | 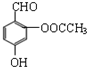 与阿斯匹林互为同分异构体,该有机物遇FeCl3溶液显紫色 与阿斯匹林互为同分异构体,该有机物遇FeCl3溶液显紫色 |
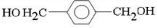 、D
、D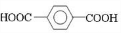 、E
、E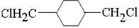 ;
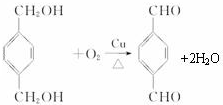
;
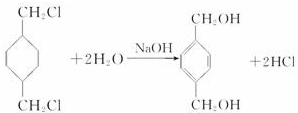 ;
; $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$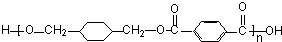 +(2n-1)H2O.
+(2n-1)H2O.