题目内容
10.下列叙述中正确的是( )| A. | NH3、CO、CO2都是极性分子 | |
| B. | CH4、CCl4都是含有极性键的非极性分子 | |
| C. | HF、HCl、HBr、HI的稳定性依次增强 | |
| D. | CS2、H2O、C2H2都是直线形分子 |
分析 A.分子结构不对称,正负电荷的中心不重合的分子为极性分子;
B.同种元素原子间形成的共价键是非极性共价键,不同种元素原子之间形成的共价键是极性共价键,由极性键构成的分子,若结构对称,正负电荷的中心重合,则为非极性分子;
C.非金属性越强,气态氢化物越稳定;
D.根据价层电子对互斥理论确定分子的空间构型,价层电子对个数=σ键个数+孤电子对个数,据此分析解答.
解答 解:A.CO2结构对称,正负电荷的中心重合,为非极性分子,而NH3、CO都是极性分子,故A错误;
B.CH4、CCl4都为正四面体结构,分别含有极性键C-H、C-Cl键,CH4、CCl4正负电荷的重心重合,电荷分布均匀,都为非极性分子,故B正确;
C.非金属的非金属性越强,其氢化物越稳定,F、Cl、Br、I的非金属性依次减弱,所以HF、HCl、HBr、HI的稳定性依次减弱,故C错误;
D.CS2以极性键相结合,碳原子杂化轨道数为$\frac{1}{2}$×(4+0)=2,采取sp杂化,具有直线型结构的分子,乙炔的结构式为H-C≡C-H,每个碳原子价层电子对个数是2且不含孤电子对,所以C原子采用sp杂化,为直线形结构;H2O中O原子的价层电子对个数=2+$\frac{1}{2}$(6-2×1)=4且含有2个孤电子对,所以O原子采用sp3杂化,其空间构型为V形结构,故D错误;
故选B.
点评 本题考查了分子的极性、同一主族元素性质递变规律、分子的空间构型,注意根据原子杂化方式判断分子构型,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.H2与D2的最确切关系是( )
| A. | 同系物 | B. | 同位素 | ||
| C. | 同素异形体 | D. | 同种物质的不同分子 |
1. 2011年8月,多家媒体报道部分山西老陈醋是由醋精勾兑而成,醋精就是冰醋酸.专家介绍,只要是符合国家标准的勾兑醋,是可以放心食用的.下列关于醋酸的说法中正确的是( )
2011年8月,多家媒体报道部分山西老陈醋是由醋精勾兑而成,醋精就是冰醋酸.专家介绍,只要是符合国家标准的勾兑醋,是可以放心食用的.下列关于醋酸的说法中正确的是( )
 2011年8月,多家媒体报道部分山西老陈醋是由醋精勾兑而成,醋精就是冰醋酸.专家介绍,只要是符合国家标准的勾兑醋,是可以放心食用的.下列关于醋酸的说法中正确的是( )
2011年8月,多家媒体报道部分山西老陈醋是由醋精勾兑而成,醋精就是冰醋酸.专家介绍,只要是符合国家标准的勾兑醋,是可以放心食用的.下列关于醋酸的说法中正确的是( )| A. | 0.01mol•L-l的醋酸溶液的Ph=2 | |
| B. | 向某温度下的醋酸溶液中通入HCl气体,醋酸的电离常数Ka会增大 | |
| C. | 等pH的盐酸与醋酸稀释后pH的变化如图所示,则曲线Ⅰ表示的是盐酸的稀释图象溶液体积 | |
| D. | 图中,a、b、c三点表示的溶液的导电性强弱关系为a<b<c |
18.下列逻辑关系图中正确的是( )
| A. |  | B. |  | C. |  | D. |  |
19.下列物质,其水溶液能导电、溶于水时化学键被破坏,但物质本身属于非电解质的是( )
| A. | C12 | B. | NH3 | C. | BaCO3 | D. | C2H5OH (乙醇) |
20.用NaBH4与FeCl3反应可制取纳米铁:2FeCl3+6NaBH4+18H2O=2Fe+6NaCl+6H3BO3+21H2↑.下列说法正确的是( )
| A. | 该反应中氧化剂只有FeCl3 | |
| B. | NaBH4的电子式为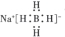 | |
| C. | NaBH4与稀硫酸不发生反应 | |
| D. | 该反应中每生成1 mol Fe,转移的电子数为3mol |
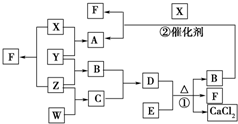 X、Y、Z、W均为气体单质,A、B、C均为无色气体化合物,D、E均为白色固体,F在通常情况下为无色无味的液体,它们有如下的转化关系:
X、Y、Z、W均为气体单质,A、B、C均为无色气体化合物,D、E均为白色固体,F在通常情况下为无色无味的液体,它们有如下的转化关系: ,F中的化学键类型为共价键.
,F中的化学键类型为共价键.