题目内容
CoCl2?6H2O是一种饲料营养强化剂.工业上利用水钴矿〔主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等〕制取CoCl2?6H2O的工艺流程如下:

已知:
①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2?6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)水钴矿进行预处理时加入Na2SO3的主要作用是 .
(2)写出NaClO3在浸出液中发生主要反应的离子方程式 ;若不慎向“浸出液”中加了过量的NaClO3,可能会生成有毒气体,写出生成该有毒气体的离子方程式 .
(3)“操作1”中包含3个基本实验操作,它们依次是 、 和过滤.
(4)浸出液加Na2CO3调pH至5.2时,所得滤液中金属离子有 .
(5)萃取液中含有的主要金属阳离子是 .
(6)为测定粗产品中CoCl2?6H2O的含量,称取16.4克的粗产品溶于水配成100.0mL溶液,从中取出25.0mL与足量AgNO3溶液混合,过滤、洗涤,将沉淀烘干后称其质量为4.6克.则粗产品中CoCl2?6H2O的质量分数是 .

已知:
①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)水钴矿进行预处理时加入Na2SO3的主要作用是
(2)写出NaClO3在浸出液中发生主要反应的离子方程式
(3)“操作1”中包含3个基本实验操作,它们依次是
(4)浸出液加Na2CO3调pH至5.2时,所得滤液中金属离子有
(5)萃取液中含有的主要金属阳离子是
(6)为测定粗产品中CoCl2?6H2O的含量,称取16.4克的粗产品溶于水配成100.0mL溶液,从中取出25.0mL与足量AgNO3溶液混合,过滤、洗涤,将沉淀烘干后称其质量为4.6克.则粗产品中CoCl2?6H2O的质量分数是
考点:制备实验方案的设计,物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:含钴废料中加入盐酸,加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2,加入NaClO3,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2,为得到CoCl2?6H2O晶体,应控制温度在86℃以下,加热时要防止温度过高而失去结晶水,可减压烘干,
(1)水钴矿进行预处理时,Na2SO3是还原剂,还原Co3+;
(2)NaClO3的作用是将Fe2+氧化成Fe3+;在酸性条件下,NaClO3与氯离子发生氧化还原反应生成氯气;
(3)根据从溶液中制取固体的方法制取氯化钴固体,从而确定操作步骤;
(4)浸出液加Na2CO3调pH至5.2时,Fe3+、Al3+沉淀完全,据此分析剩余的金属离子;
(5)由流程图可知,加入萃取剂,萃取Mn2+;
(6)根据CoCl2?6H2O关系式求质量分数.
(1)水钴矿进行预处理时,Na2SO3是还原剂,还原Co3+;
(2)NaClO3的作用是将Fe2+氧化成Fe3+;在酸性条件下,NaClO3与氯离子发生氧化还原反应生成氯气;
(3)根据从溶液中制取固体的方法制取氯化钴固体,从而确定操作步骤;
(4)浸出液加Na2CO3调pH至5.2时,Fe3+、Al3+沉淀完全,据此分析剩余的金属离子;
(5)由流程图可知,加入萃取剂,萃取Mn2+;
(6)根据CoCl2?6H2O关系式求质量分数.
解答:
解:(1)水钴矿进行预处理时,Na2SO3是还原剂,还原Co3+为Co2+,反应的离子方程式为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O,
故答案为:还原Co3+;
(2)NaClO3的作用是将Fe2+氧化成Fe3+,其反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;在酸性条件下,NaClO3与氯离子发生氧化还原反应生成氯气,其反应的离子方程式为:ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
(3)利用从溶液中制取固体的方法制取氯化钴固体,其操作步骤为:蒸发浓缩、冷却结晶和过滤;
故答案为:蒸发;冷却;
(4)NaClO3的作用是将Fe2+氧化成Fe3+,加Na2CO3调pH至5.2,Fe3+、Al3+沉淀完全,此时溶液中的金属离子主要有Co2+、Mn2+、Na+,
故答案为:Co2+、Mn2+、Na+;
(5)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子;由萃取剂对金属离子的萃取作用可知,此时萃取液中金属离子为Mn2+,
故答案为:Mn2+;
(6)根据CoCl2?6H2O~2AgCl,16.4g
238 287
x 4.6g,x=3.81g
则粗产品中CoCl2?6H2O的质量分数是
×100%=93.0%,
故答案为:93.0%.
故答案为:还原Co3+;
(2)NaClO3的作用是将Fe2+氧化成Fe3+,其反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;在酸性条件下,NaClO3与氯离子发生氧化还原反应生成氯气,其反应的离子方程式为:ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
(3)利用从溶液中制取固体的方法制取氯化钴固体,其操作步骤为:蒸发浓缩、冷却结晶和过滤;
故答案为:蒸发;冷却;
(4)NaClO3的作用是将Fe2+氧化成Fe3+,加Na2CO3调pH至5.2,Fe3+、Al3+沉淀完全,此时溶液中的金属离子主要有Co2+、Mn2+、Na+,
故答案为:Co2+、Mn2+、Na+;
(5)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子;由萃取剂对金属离子的萃取作用可知,此时萃取液中金属离子为Mn2+,
故答案为:Mn2+;
(6)根据CoCl2?6H2O~2AgCl,16.4g
238 287
x 4.6g,x=3.81g
则粗产品中CoCl2?6H2O的质量分数是
3.82g×
| ||
| 16.4g |
故答案为:93.0%.
点评:本题通过制取CoCl2?6H2O的工艺流程,考查了物质制备方案的设计,题目难度大,理解工艺流程图、明确实验操作与设计及相关物质的性质是解答本题的关键,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
2011年3月11日日本发生9.0级的强震并引发海啸和核泄露,核电站周围检测到放射性物质碘131,下列有关说法正确的是( )
| A、核裂变是一种化学变化 |
| B、131I 与127I互为同素异形体 |
| C、131I 原子的中子数为78 |
| D、碘在周期表中位于第四周期ⅦA族 |
热水法制Fe3O4纳米颗粒的反应为:3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O下列说法正确的是( )
| A、将纳米Fe3O4分散在水中没有丁达尔现象 |
| B、将纳米Fe3O4分散在水中Fe3O4不能透过滤纸 |
| C、每生成1 mol Fe3O4反应转移的电子数为4 NA |
| D、反应物OH-的化学计量数x=2 |
下列离子方程式正确的是( )
| A、澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2O | ||||
| B、钠与水的反应:2Na+2H2O═2 Na++2OH-+H2↑ | ||||
| C、稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | ||||
D、向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
|
下列有关实验操作的说法错误的是( )
| A、中和滴定时盛待测液的锥形瓶中有少量水对滴定结果无影响 |
| B、在酸碱中和滴定实验中,滴定管都需润洗,否则引起误差 |
| C、滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 |
| D、称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘 |
下列关于难溶电解质AgBr的说法正确的是( )
| A、在一定温度下,AgBr水溶液中c(Br-)和c(Ag+)的乘积是一个常数 |
| B、AgBr水溶液的导电能力很弱,所以AgBr为弱电解质 |
| C、室温下,AgBr在纯水中的溶解度大于在KBr溶液中的溶解度 |
| D、向饱和AgBr悬浊液中加入盐酸c(Br-)增大,Ksp值变大 |
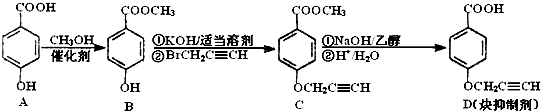
 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成: