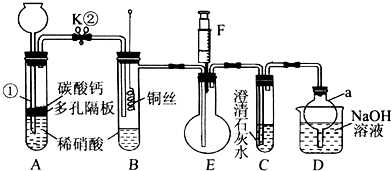
题目内容
14. 留心处处皆学问.从生活出发进行科学探究,可以获得自信,形成正确的思维方式.甲、乙两位同学一起合作设计完成了水果电池的实验(如图),测得数据如下
留心处处皆学问.从生活出发进行科学探究,可以获得自信,形成正确的思维方式.甲、乙两位同学一起合作设计完成了水果电池的实验(如图),测得数据如下| 实验序号 | 电极材料 | 水果种类 | 电极间距离/cm | 电压/mV |
| 1 | 锌铜 | 菠萝 | 3 | 900 |
| 2 | 锌铜 | 苹果 | 3 | 650 |
| 3 | 锌铜 | 柑橘 | 3 | 850 |
| 4 | 锌铜 | 西红柿 | 3 | 750 |
| 5 | 锌铝 | 菠萝 | 3 | 650 |
| 6 | 锌铝 | 苹果 | 3 | 450 |
| 甲同学 | 乙同学 | |
| A | 实验6中负极电极反应式如何写? | Al-3e-=Al3+ |
| B | 实验1,5中电流方向为什么相反? | 1中锌为负极,电流由铜经导线流向锌,5中铝为负极,铝失去电子,电流由锌经导线流向铝 |
| C | 水果电池的电压与哪些因素有关? | 只跟水果的类型有关 |
| D | 实验中发光二极管不亮,如何使它亮起来 | 可用铜锌作电极,用菠萝作介质,并将多个此电池串联起来 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.铝比锌活泼,铝为负极;
B.1中锌为负极,铜为正极,5中铝为负极,锌为正极;
C.由表中数据可知电解液相同,电极不同,电压不同;
D.增大电压,可使发光二极管变亮.
解答 解:A.铝的金属性比锌强,作原电池为负极,故A正确;
B.实验1中活泼金属锌为负极,铜为正极,电流从铜流向锌;实验5中活泼金属铝为负极,电流从锌流向铝,故B正确;
C.电压的高低可能还与电极材料、电极间距离等因素有关,故C错误;
D.串联电压增大,发光二极管变亮,故D正确.
故选C.
点评 本题考查原电池知识,为高频考点,侧重于学生的分析、实验能力的考查,题目贴近生活、来源生活,有利于培养学生良好的科学素养,提高学生学习的积极性,注意把握提给数据的分析以及原电池的工作原理,难度不大.

练习册系列答案
相关题目
4.下列图象表达正确的是( )
| A. | 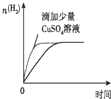 等质量锌粉与足量盐酸反应 | |
| B. | 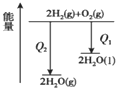 氢气与氧气反应中的能量变化 | |
| C. | 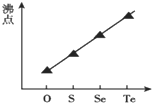 气态氢化物沸点 | |
| D. | 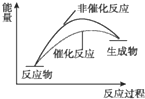 催化反应与非催化反应过程中的能量关系 |
2.下列说法正确的是( )
| A. | 一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度 | |
| B. | 增大反应物浓度,能增大活化分子百分数,所以反应速率增大 | |
| C. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| D. | 100 mL 2 mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 |
19.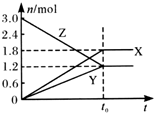 在一定温度下,将一定量的气体通入体积为2 L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )
在一定温度下,将一定量的气体通入体积为2 L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )
 在一定温度下,将一定量的气体通入体积为2 L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )
在一定温度下,将一定量的气体通入体积为2 L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )| A. | 该反应的化学方程式为:3Z═3X+2Y | B. | t0时,X、Y、Z的质量不再改变 | ||
| C. | t0时,Z的浓度为1.2 mol/L | D. | t0时,反应停止,反应速率为0 |
3.将充有m mL NO和n mL NO2的量筒倒立于水槽中,然后通入m mL O2,若m<n,则充分反应后,量筒内气体的体积为( )
| A. | 3(m-n) mL | B. | $(m+\frac{n}{3})$ mL | C. | $\frac{n-m}{3}$ mL | D. | $\frac{4n-m}{12}$ mL |
4.下列说法不正确的是( )
| A. | 海水淡化的主要方法有蒸馏法、电渗析法、离子交换法、反渗透法等 | |
| B. | 海水中的无机盐主要以Na+、Mg2+、K+、Ca2+、SO42-、Cl-、Br-等形式存在 | |
| C. | 海生植物如海带中存在较高浓度的I2,具有很高的开发利用价值 | |
| D. | 从海水中可以提取核反应材料 |
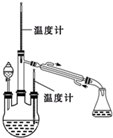 肼是重要的化工原料.某研究小组利用下列反应制取水合肼(N2H2•H2O):CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl
肼是重要的化工原料.某研究小组利用下列反应制取水合肼(N2H2•H2O):CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl