题目内容
16.下列物质中都含有氢元素,按照已学知识判断其中属于酸的是( )| A. | NH3 | B. | CH4 | C. | NaHCO3 | D. | HClO |
分析 电离时生成的阳离子全部是氢离子的化合物叫做酸.
解答 解:A、氨气不是酸,故A错误;
B、甲烷含有氢元素,属于烃类,不能电离,故B错误;
C、碳酸氢钠含有氢元素,属于盐类,电离时生成的阳离子为氢离子和钠离子,属于酸式盐,故C错误;
D、氯酸电离时生成的阳离子全部是氢离子,属于酸,故D正确.
故选D.
点评 本题考查学生酸的含义和物质的分类知识,可以根据教材知识来回答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.香叶醇是合成玫瑰香油的主要原料,其结构简式如图所示.下列有关香叶醇的叙述正确的是( )
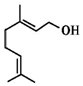

| A. | 不能使溴的四氯化碳溶液褪色 | B. | 香叶醇的分子式为C10H20O | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 能发生取代反应和加成反应 |
7.下列说法正确的是( )
| A. | 氢键、分子间作用力、离子键、共价键都是微粒间的作用力,其中氢键、离子键和共价键是化学键 | |
| B. | 石墨烯是一种从石墨材料中用“撕裂”方法剥离出的单层碳原子面材料,用这种方法从C60、金刚石等中获得“只有一层碳原子厚的碳薄片”也必将成为研究方向 | |
| C. | 下列物质的熔沸点由大到小排列:晶体硅>碳化硅>金刚石 | |
| D. | 黄色晶体碳化铝,熔点2200℃,熔融态不导电,是原子晶体 |
4.在乙醇的化学性质中,各反应的断键方式不正确的是( )
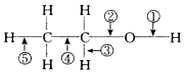

| A. | 与浓硫酸混合加热至170℃,断②⑤ | B. | 与氢卤酸反应断② | ||
| C. | 分子间脱水断①或② | D. | 与醋酸反应断② |
11.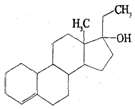 为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述错误的是( )
为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述错误的是( )
 为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述错误的是( )
为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述错误的是( )| A. | 分子式为C20H30O | |
| B. | 能使溴的四氯化碳溶液褪色 | |
| C. | 能发生加成、取代、氧化反应 | |
| D. | 在浓硫酸作用下,分子内脱去一个水分子,产物有两种 |
1.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| B. | 无色溶液中:K+、Fe3+、SO42-、H+ | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012 的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 由水电离的c (H+)=1×10一14 mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
8.下列有关说法正确的是( )
| A. | 升高温度使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小体积)可增加活化分子的百分数使化学反应速率增大 | |
| C. | 加入反应物,使活化分子的百分数增加,反应速率加快 | |
| D. | 活化分子间发生的碰撞为有效碰撞 |
5.下列说法正确的是(设阿伏加德罗常数的数值为 NA)( )
| A. | 在标准状况下,22.4L 水所含分子数目为 NA | |
| B. | 1mol•L-1K2SO4溶液所含 K+数目为 2NA | |
| C. | 1 mol 钠与氧气反应生成 Na2O 或 Na2O2时,失电子数目均为 NA | |
| D. | O2 的摩尔体积约为 22.4 L•mol-1 |
7.下列说法正确的是( )
| A. | 化学平衡常数是受溶液的浓度、气体的压强、体系的温度等外界条件影响的 | |
| B. | 某电解质溶液中,温度升高,Kw增大,则溶液的酸性或碱性一定增强 | |
| C. | H2CO3的电离常数表达式:K=$\frac{c({H}^{+})•c(C{O}_{3}^{2-})}{c({H}_{2}C{O}_{3})}$ | |
| D. | 电离平衡常数可以表示弱电解质的相对强弱 |