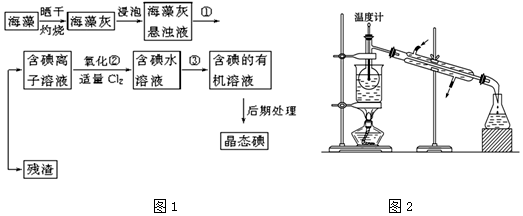
题目内容
10.标准状况下,下列物质中,其体积最大的是( )| A. | 44g CO2 | B. | 11.2L H2 | C. | 2mol Fe | D. | 2mol H2O |
分析 根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$计算,注意标准状况下,水为液体,铁是固体,由此分析解答.
解答 解:A、44g CO2的物质的量为1mol,
B、11.2L H2的物质的量为0.5mol,
C、铁是固体,
D、水是液体
综上所述体积最大的是A,故选A.
点评 本题考查物质的量的相关计算,侧重于学生的分析能力和计算能力的考查,难度不大,注意相关计算公式的运用与相关物理量的关系.

练习册系列答案
相关题目
11.化学与生产、生活、科技等密切相关,下列说法正确的是( )
| A. | 由石油制取乙烯、丙烯等化工原料不涉及化学变化 | |
| B. | “神州七号”的防护层中含聚四氟乙烯,制备聚四氟乙烯的单体属于不饱和烃 | |
| C. | 浓硫酸可用于干燥SO2、C2H4、O2等气体 | |
| D. | 用CO2合成可降解的聚碳酸酯塑料,可以实现“碳”的循环利用 |
5.据报道,结构式为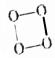 的O4是一种价格超过黄金的气体,下列有关O4的说法中不正确的是( )
的O4是一种价格超过黄金的气体,下列有关O4的说法中不正确的是( )
 的O4是一种价格超过黄金的气体,下列有关O4的说法中不正确的是( )
的O4是一种价格超过黄金的气体,下列有关O4的说法中不正确的是( )| A. | O4与O3、O2互为同素异形体 | |
| B. | O4与H2反应生成冰 | |
| C. | O4中各原子最外电子层均达到8电子结构 | |
| D. | O4的化学性质一定比O2稳定 |
15.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2LC2H5OH含有的氢原子数为3NA | |
| B. | 25℃时,1LpH=12的碳酸钠溶液中含有Na+的数目为0.02NA | |
| C. | 过氧化钠与水反应时,生成0.5molO2转移的电子数为NA | |
| D. | 2molSO2和1molO2在一定条件下充分反应,所得混合气体的分子数等于2NA |
2.既存在σ键也存在π键且σ键与π键数目之比为1:1的是( )
| A. | N2 | B. | CH2=CH2 | C. | HCN | D. | C3H6(环丙烷) |
19.研究碳、氮及其化合物的转化对于环境的改善有重大意义.
(1)氧化还原法消除NOx的转化如下:NO$→_{反应Ⅰ}^{O_{3}}$NO2$→_{反应Ⅱ}^{CO(NH_{2})_{2}}$N2
已知:NO(g)+O3(g)═NO2(g)+O2(g)△H=-200.9kJ/mol
2NO(g)+O2(g)═2NO(g)△H=-116.2kJ/mol
则反应I的热化学方程式为3NO(g)+O3(g)═3NO2(g)△H=-317.1 kJ•mol-1.
(2)有人设想将CO按下列反应除去:2CO(g)═2C(s)+O2(g)△H>0,请你分析该设想能否实现?否(填“是”或“否”),依据是该反应是焓增、熵减的反应,根据G=△H-T•△S,G>0.
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠.已知常温时,甲酸的电离平衡常数Ka=1.70×10-4.
①甲酸钠的水溶液呈碱性,请用离子反应方程式表示其原因HCOO-+H2O?HCOOH+OH-.
②向20mL 0.1mol/L的甲酸钠溶液中滴加10ml 0.1mol/L的盐酸,混合液呈酸性(填“酸”或“碱”),溶液中离子浓度从大到小的顺序为c(Na+)>c(HCOO-)>c(Cl-)>c(H+)>c(OH-).
(4)活性炭也可用于处理汽车尾气中的NO.在2L恒容密闭容器中加入0.1000molNO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如表:
①该反应的正反应为放热(填”吸热”或“放热”)反应.
②200℃时,平衡后向恒容容器中再充入0.1molNO,再次平衡后,NO的百分含量将不变.(填“增大”、“减小”或“不变”).
③计算反应体系在335℃时的平衡常数0.25.
(1)氧化还原法消除NOx的转化如下:NO$→_{反应Ⅰ}^{O_{3}}$NO2$→_{反应Ⅱ}^{CO(NH_{2})_{2}}$N2
已知:NO(g)+O3(g)═NO2(g)+O2(g)△H=-200.9kJ/mol
2NO(g)+O2(g)═2NO(g)△H=-116.2kJ/mol
则反应I的热化学方程式为3NO(g)+O3(g)═3NO2(g)△H=-317.1 kJ•mol-1.
(2)有人设想将CO按下列反应除去:2CO(g)═2C(s)+O2(g)△H>0,请你分析该设想能否实现?否(填“是”或“否”),依据是该反应是焓增、熵减的反应,根据G=△H-T•△S,G>0.
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠.已知常温时,甲酸的电离平衡常数Ka=1.70×10-4.
①甲酸钠的水溶液呈碱性,请用离子反应方程式表示其原因HCOO-+H2O?HCOOH+OH-.
②向20mL 0.1mol/L的甲酸钠溶液中滴加10ml 0.1mol/L的盐酸,混合液呈酸性(填“酸”或“碱”),溶液中离子浓度从大到小的顺序为c(Na+)>c(HCOO-)>c(Cl-)>c(H+)>c(OH-).
(4)活性炭也可用于处理汽车尾气中的NO.在2L恒容密闭容器中加入0.1000molNO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如表:
| 固体活性炭/mol | NO/mol | A/mol | B/mol | |
| 200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 |
| 335℃ | 2.005 | 0.0500 | 0.0250 | 0.0250 |
②200℃时,平衡后向恒容容器中再充入0.1molNO,再次平衡后,NO的百分含量将不变.(填“增大”、“减小”或“不变”).
③计算反应体系在335℃时的平衡常数0.25.
20.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 0.2 mol的铁与足量的稀硝酸反应,生成气体的分子数目为0.3 NA | |
| B. | 常温常压下,14 g由 C2H4、C3H6组成的混合气体中含有碳原子的数目为NA | |
| C. | 2.24 L CO2与足量的Na2O2反应,转移的电子总数必为0.1NA | |
| D. | l Ll mol/L的KAl(SO4)2溶液中阳离子总数为2 NA |