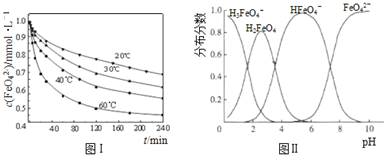
题目内容
从能量的角度看,断开化学键要 ,形成化学键要 .已知拆开1mol H-H键、1mol I-I、1mol H-I键分别需要吸收的能量为436kJ、151k J、299k J.则由氢气和碘反应生成1mol HI需要 (填“放出”或“吸收”) k J的热量.当反应物的总能量高于生成物总能量时,该反应为 反应;当反应物的总能量低于生成物总能量时,该反应为 反应.
考点:化学反应中能量转化的原因
专题:化学反应中的能量变化
分析:化学反应的实质是旧键的断裂和新键的形成.断裂旧键需要吸收能量,形成新键需要释放能量,反应吸热还是放热取决于断键吸收的热量与成键释放的热量多少;反应热△H=反应物总键能-生成物总键能;依据能量守恒规律判断反应热效应与反应物和生成物能量高低的关系.
解答:
解:化学反应的实质是旧键的断裂和新键的形成,从能量的角度看,断开化学键要吸收能量,形成化学键要释放能量;
氢气与碘反应的化学方程式:H2+I2=2HI
依据△H=反应物总键能-生成物总键能,生成2molHI,△H=436KJ+151KJ-299KJ×2=-11KJ/mol,则生成1molHI放出的热量为:
KJ=5.5KJ;
依据能量守恒定律:当反应物的总能量高于生成物总能量时,反应放热;当反应物的总能量低于生成物总能量时,反应吸热;
故答案为:吸收热量;放出能量;放出; 5.5;吸热; 放热.
氢气与碘反应的化学方程式:H2+I2=2HI
依据△H=反应物总键能-生成物总键能,生成2molHI,△H=436KJ+151KJ-299KJ×2=-11KJ/mol,则生成1molHI放出的热量为:
| 11 |
| 2 |
依据能量守恒定律:当反应物的总能量高于生成物总能量时,反应放热;当反应物的总能量低于生成物总能量时,反应吸热;
故答案为:吸收热量;放出能量;放出; 5.5;吸热; 放热.
点评:本题考查了化学反应中能量变化原因,题目难度不大,注意结和化学反应的实质和能量守恒定律解答.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
R元素的原子,其最外层电子数是次外层的电子数的2倍,则R是( )
| A、S | B、Si | C、Na | D、C |
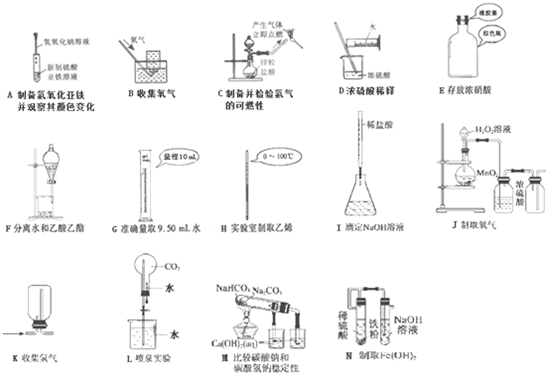
 ①e处发生反应的离子方程式为
①e处发生反应的离子方程式为