题目内容
下列对沉淀溶解平衡的描述正确的是( )
| A、反应开始时,溶液中各离子浓度相等 |
| B、达到平衡时,沉淀的速率和溶解的速率相等 |
| C、达到平衡时,溶液中溶质的离子浓度相等,且保持不变 |
| D、达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:A、反应开始时,各离子的浓度没有必然的关系;
B、沉淀的速率和溶解的速率相等,沉淀溶解达到平衡;
C、沉淀溶解达到平衡时,溶液中溶质的离子浓度保持不变,但不一定相等;
D、固体的浓度为常数,加入难溶的该沉淀物,平衡不发生移动.
B、沉淀的速率和溶解的速率相等,沉淀溶解达到平衡;
C、沉淀溶解达到平衡时,溶液中溶质的离子浓度保持不变,但不一定相等;
D、固体的浓度为常数,加入难溶的该沉淀物,平衡不发生移动.
解答:
解:A、反应开始时,各离子的浓度没有必然的关系,故A错误;
B、沉淀的速率和溶解的速率相等,沉淀溶解达到平衡,故B正确;
C、沉淀溶解达到平衡时,溶液中溶质的离子浓度保持不变,但不一定相等,与难溶二者是否是1:1型有关、与溶解难溶物质的溶液中是否存在难溶物质的离子等有关,故C错误;
D、沉淀溶解达到平衡时,如果再加入难溶的该沉淀物,由于固体的浓度为常数,故平衡不发生移动,故D错误;
故选B.
B、沉淀的速率和溶解的速率相等,沉淀溶解达到平衡,故B正确;
C、沉淀溶解达到平衡时,溶液中溶质的离子浓度保持不变,但不一定相等,与难溶二者是否是1:1型有关、与溶解难溶物质的溶液中是否存在难溶物质的离子等有关,故C错误;
D、沉淀溶解达到平衡时,如果再加入难溶的该沉淀物,由于固体的浓度为常数,故平衡不发生移动,故D错误;
故选B.
点评:本题考查难溶物质的溶解平衡,难度不大,注意利用平衡移动原理、溶度积常数理解.

练习册系列答案
相关题目
在一定温度下,氯化银在水中存在如下沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq),若把AgCl分别放入①100mL0.1mol/LNa2SO4溶液中;②100mL0.1mol/L NaCl溶液中;③100mL0.1mol/L AlCl3溶液中;④100mL0.1mol/L MgCl2溶液中.搅拌后在相同的温度下Ag+浓度由大到小的顺序是( )
| A、①>②>④>③ |
| B、②>①>④>③ |
| C、④>③>②>① |
| D、①>④>③>② |
某元素原子核外L层电子数是其他层电子数之和,则该元素的核电荷数为( )
| A、8 | B、12 | C、16 | D、4 |
下列实验操作错误的是( )
A、 稀释浓硫酸 |
B、 添加酒精 |
C、 氧气验满 |
D、 测溶液pH |
有机物A的分子式为C6H12O2,在一定条件下发生如下转化关系,且D和E都不能发生银镜反应,由此推断A的可能结构有( )


| A、6种 | B、4种 | C、3种 | D、2种 |

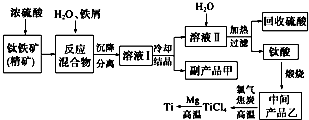 金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.“硫酸法”生产钛的原料是钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质);主要生产流程如下:
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.“硫酸法”生产钛的原料是钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质);主要生产流程如下: