题目内容
5.请在标有序号的空白处填空:(1)利用催化剂可使NO和CO发生反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0.已知增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面的表中.
①请填全表中的各空格;
| 实验 编号 | T(℃) | NO初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂的比表 面积(m2•g-1) |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 1.2×10-3 | 124 | ||
| Ⅲ | 350 | 82 |
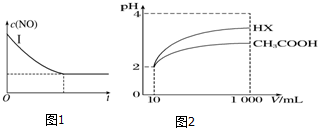
请在给出的坐标图中画出实验Ⅱ、Ⅲ中NO的物质的量浓度(c)随时间(t)变化的曲线,并标明各曲线的实验编号.
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g) H=64.39KJ•mol-1
2H2O2(l)═2H2O(l)+O2(g) H=196.46KJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l) H=-285.84KJ•mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-319.68kJ/mol.
(3)25℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平 衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
①CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为CH3COOH>H2CO3>HClO.
②体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图2所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是稀释相同倍数,HX的pH变化比CH3COOH的大,酸性强,电离平衡常数大.
(4)①求常温下pH=2的H2SO4溶液中由H2O电离的c(H+)和c(OH-).
c(H+)=10-12mol•L-1,c(OH-)=10-12mol•L-1.
②在某温度时,测得0.01mol•L-1的NaOH溶液的pH=11.在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合.若所得混合液为中性,且a+b=12,则Va:Vb=10:1.
分析 (1)①根据实验目的验证温度、催化剂比表面积对化学反应速率的影响规律,则应保证浓度相同,然后相同温度时比较催化剂比表面积,相同催化剂比、表面积时比较温度;
②利用影响化学反应速率及化学平衡的因素来分析图象;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(3)①电离平衡常数越大,酸的电离程度越大,溶液酸性越强;
②由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;
(4)①硫酸电离出的氢离子抑制了水的电离,硫酸溶液中的氢氧根离子是水电离的,据此计算出溶液水电离的氢离子和氢氧根离子浓度;
②0.01mol/L的NaOH溶液的pH为11,则c(H+)=1×10-11mol/L,c(OH-)=0.01mol/L,根据Kw=c(H+)×c(OH-)计算水的离子积,若所得混合溶液为中性,且a=2,b=12,根据c(OH-)×Vb=c(H+)×Va计算Va:Vb.
解答 解:(1)①因Ⅰ、Ⅱ比表面积不同,则应控制温度相同,所有浓度应控制相同来验证催化剂比表面积对速率的影响;
I、Ⅲ比表面积相同,温度不同,则所有浓度应控制相同来验证反应温度对速率的影响,
故答案为:
| 实验 编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的 比表面积(m2/g) |
| Ⅰ | ||||
| Ⅱ | 280 | 5.80×10-3 | ||
| Ⅲ | 1.20×10-3 | 5.80×10-3 |
②因Ⅰ、Ⅱ温度相同,催化剂对平衡移动无影响,则平衡不移动,但Ⅱ的速率大,则Ⅱ先达到化学平衡,Ⅰ、Ⅱ达平衡时NO的浓度相同;而Ⅲ的温度高,则反应速率最大且平衡逆移,即达到化学平衡时c(NO)增大,据此画出的图象为:
 ,
,故答案为:
 ;
;(2):①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ/mol,
②2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ/mol,
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l) H=-285.84KJ•mol-1,
由盖斯定律①+$\frac{1}{2}$②+③得到:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-319.68kJ/mol,
故答案为:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-319.68kJ/mol;
(3)①根据表中数据可知,酸的电离出平衡常数大小为:CH3COOH>H2CO3>HCO3->HClO,电离平衡常数越大,酸性越强,所以酸性由强到弱的顺序为为:CH3COOH>H2CO3>HClO,
故答案为:CH3COOH>H2CO3>HClO;
②根据图象分析知道,起始是两种溶液中c(H+)相同,c(较弱酸)>c(较强酸),稀释过程中较弱酸的电离程度增大,故在整个稀释过程中较弱酸的c(H+)一直大于较强酸的c(H+),稀释相同倍数,HX的pH变化比CH3COOH的大,故HX酸性强,电离平衡常数大,
故答案为:大于;稀释相同倍数,HX的pH变化比CH3COOH的大,酸性强,电离平衡常数大;
(4)①常温下pH=2的H2SO4溶液中氢离子抑制了水的电离,硫酸溶液中的氢氧根离子水电离的,则由H2O电离的c(H+)=c(OH-)=$\frac{1{0}^{-12}}{0.01mol/L}$=10-12mol•L-1,
故答案为:10-12mol•L-1;10-12mol•L-1;
②0.01mol/L的NaOH溶液的pH为11,则c(H+)=1×10-11mol/L,c(OH-)=0.01mol/L,Kw=c(H+)×c(OH-)=1×10-13;
将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合溶液为中性,且硫酸的pH=a=2,氢离子浓度为0.01mol/L,氢氧化钠溶液的pH=b=12,则氢氧根离子浓度为0.1mol/L,
混合液为中性,则c(H+)×Va=c(OH-)×Vb,
即:0.01Va=0.1×Vb,
整理可得:Va:Vb=10:1,
故答案为:10:1.
点评 本题考查较为综合,涉及酸碱混合的定性判断及溶液pH的计算、热化学方程式的计算、化学反应速率的影响因素等知识,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握影响化学反应速率的因素,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
16.在抗震救灾中要用大量漂白粉和漂白液杀菌消毒.下列说法正确的是( )
| A. | 漂白粉是混合物,漂粉精是纯净物 | |
| B. | 工业上将氯气通入澄清石灰水制取漂白粉 | |
| C. | 漂白粉的有效成分是Ca(ClO)2 | |
| D. | 漂白液的有效成份是Na2O2 |
17.用98%(质量分数)的浓硫酸来配制一定体积的1.0mol•L-1的稀硫酸时,不需要用到下列哪种仪器( )
| A. | 玻璃棒 | B. | 胶头滴管 | C. | 托盘天平 | D. | 容量瓶 |
14.防冻剂是一种能在低温下防止物料中水分结冰的物质.下列可用于防冻剂的物质中,含有氮元素的有机物是( )
| A. | 甲醇[CH3OH] | B. | 氯化钙[CaCl2] | C. | 尿素[CO(NH2)2] | D. | 亚硝酸钠[NaNO2] |
15.如表各组物质中,不能按 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )
 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )| 选项 | a | b | c |
| A | Fe | FeCl3 | FeCl2 |
| B | MgO | MgCl2 | Mg(OH)2 |
| C | Si | SiO2 | H2SiO3 |
| D | NaOH | Na2CO3 | Na2SO3 |
| A. | A | B. | B | C. | C | D. | D |
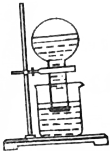 甲同学按如图所示装置做新制氯水受日光照射分解放出O2的验证实验,结果现象不明显.
甲同学按如图所示装置做新制氯水受日光照射分解放出O2的验证实验,结果现象不明显.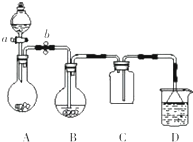 某化学小组设计了如图所示装置.用以探究Cu跟浓H2SO4的反应并收集少量气态产物(加热及夹持装置省略).
某化学小组设计了如图所示装置.用以探究Cu跟浓H2SO4的反应并收集少量气态产物(加热及夹持装置省略).