题目内容
原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,F+的三个能层电子全充满.下表是主要化合价及原子半径数据:
(1)B、C、D三种元素第一电离能数值由小到大的顺序是 (填元素符号);
(2)B的氢化物中心原子采取 杂化,空间构型是 形,是 分子(填“极性”或“非极性”);
(3)F2+与NH3形成配离子的结构式为 ;往某种蓝色溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,可得到含有上述配离子的配合物.写出沉淀溶解的离子方程式 .
(4)A、E两种元素形成晶体晶胞是图中的 (填①、②、③或④);

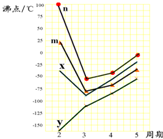
(5)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,请选出C的氢化物所在的折线 (填n、m、x或y).
| A | B | C | D | E | F | |
| 主要化合价 | -1 | -3+5 | -2+6 | -1+7 | +2 | +1+2 |
| 原子半径 | 0.071 | 0.11 | 0.102 | 0.099 | 0.197 | 0.117 |
(2)B的氢化物中心原子采取
(3)F2+与NH3形成配离子的结构式为
(4)A、E两种元素形成晶体晶胞是图中的

(5)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,请选出C的氢化物所在的折线

考点:晶胞的计算,元素电离能、电负性的含义及应用,配合物的成键情况,原子轨道杂化方式及杂化类型判断
专题:原子组成与结构专题,化学键与晶体结构
分析:根据图表知,-1价的A、D元素处于第VIIA,且B原子序数小于D,所以A是F元素,D是Cl元素,A、B、C、D是短周期非金属元素,B、C、D同周期,-3、+5价的B元素处于第VA族且为第三周期,所以B是P元素,则C是S元素;E、F是第四周期的金属元素,F+的三个能层电子全充满,则F原子核外有29个电子,所以F是Cu元素,+2价的E属于第IIA、第四周期元素,所以E是Ca元素.
(1)同一周期元素的第一电离能随着原子序数的增大而增大,但第VIA族元素小于第VA族元素的第一电离能;
(2)根据其价层电子对互斥理论确定其空间构型、杂化方式,根据其结构确定其分子的极性;
(3)溶液显蓝色说明含有铜离子,铜离子和氨水反应生成氢氧化铜蓝色沉淀,氢氧化铜和氨水反应生成铜氨络合物;
(4)根据氟化钙的化学式确定其晶胞,氟化钙晶胞中含有一个钙离子、两个氟离子;
(5)硫处于第VIA元素,根据第二周期元素氢化物的沸点结合状态判断.
(1)同一周期元素的第一电离能随着原子序数的增大而增大,但第VIA族元素小于第VA族元素的第一电离能;
(2)根据其价层电子对互斥理论确定其空间构型、杂化方式,根据其结构确定其分子的极性;
(3)溶液显蓝色说明含有铜离子,铜离子和氨水反应生成氢氧化铜蓝色沉淀,氢氧化铜和氨水反应生成铜氨络合物;
(4)根据氟化钙的化学式确定其晶胞,氟化钙晶胞中含有一个钙离子、两个氟离子;
(5)硫处于第VIA元素,根据第二周期元素氢化物的沸点结合状态判断.
解答:
解:根据图表知,-1价的A、D元素处于第VIIA,且B原子序数小于D,所以A是F元素,D是Cl元素,A、B、C、D是短周期非金属元素,B、C、D同周期,-3、+5价的B元素处于第VA族且为第三周期,所以B是P元素,则C是S元素;E、F是第四周期的金属元素,F+的三个能层电子全充满,则F原子核外有29个电子,所以F是Cu元素,+2价的E属于第IIA、第四周期元素,所以E是Ca元素.
(1)同一周期元素的第一电离能随着原子序数的增大而增大,但第VIA族元素小于第VA族元素的第一电离能,所以B、C、D三种元素第一电离能数值由小到大的顺序是S<P<Cl,
故答案为:S<P<Cl;
(2)PH3分子P原子含有3个σ键一个孤电子对,所以采用Sp3杂化,其空间构型是三角锥形,该分子是不对称性结构,正负电荷中心不重合,所以是极性分子,
故答案为:Sp3;三角锥;极性;
(3)铜离子和氨分子形成配离子的结构式为[ ]2+,溶液显蓝色说明含有铜离子,铜离子和氨水反应生成氢氧化铜蓝色沉淀,氢氧化铜和氨水反应生成铜氨络合物,反应方程式为Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,
]2+,溶液显蓝色说明含有铜离子,铜离子和氨水反应生成氢氧化铜蓝色沉淀,氢氧化铜和氨水反应生成铜氨络合物,反应方程式为Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:[ ]2+;Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O;
]2+;Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O;
(4)氟化钙的化学式为CaF2,氟化钙晶胞中含有一个钙离子、两个氟离子,
①晶胞中小黑色球,处于晶胞内部,数目为4,大灰色球数目为8×
+6×
=4,原子数目之比为1:1,故错误;
②晶胞中蓝色球数目为8,黄色球数目为8×
+6×
=4,原子数目之比为2:1,故正确;
③由晶胞可知,只含1种原子,属于单质,故错误;
④晶胞中黑色球数目为8×
+6×
=4,白色球数目为1+12×
=4,原子数目之比为1:1,故错误;
故选②;
(5)C是S元素,处于ⅥA族,在ⅣA族、ⅤA族、ⅥA族、ⅦA族元素,第二周期元素形成的氢化物中,H2O通常为液体,沸点最高,故折线n表示第ⅥA族元素氢化物的沸点变化,故H2S所在的折线为n,故答案为:n.
(1)同一周期元素的第一电离能随着原子序数的增大而增大,但第VIA族元素小于第VA族元素的第一电离能,所以B、C、D三种元素第一电离能数值由小到大的顺序是S<P<Cl,
故答案为:S<P<Cl;
(2)PH3分子P原子含有3个σ键一个孤电子对,所以采用Sp3杂化,其空间构型是三角锥形,该分子是不对称性结构,正负电荷中心不重合,所以是极性分子,
故答案为:Sp3;三角锥;极性;
(3)铜离子和氨分子形成配离子的结构式为[
 ]2+,溶液显蓝色说明含有铜离子,铜离子和氨水反应生成氢氧化铜蓝色沉淀,氢氧化铜和氨水反应生成铜氨络合物,反应方程式为Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,
]2+,溶液显蓝色说明含有铜离子,铜离子和氨水反应生成氢氧化铜蓝色沉淀,氢氧化铜和氨水反应生成铜氨络合物,反应方程式为Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,故答案为:[
 ]2+;Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O;
]2+;Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O;(4)氟化钙的化学式为CaF2,氟化钙晶胞中含有一个钙离子、两个氟离子,
①晶胞中小黑色球,处于晶胞内部,数目为4,大灰色球数目为8×
| 1 |
| 8 |
| 1 |
| 2 |
②晶胞中蓝色球数目为8,黄色球数目为8×
| 1 |
| 8 |
| 1 |
| 2 |
③由晶胞可知,只含1种原子,属于单质,故错误;
④晶胞中黑色球数目为8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
故选②;
(5)C是S元素,处于ⅥA族,在ⅣA族、ⅤA族、ⅥA族、ⅦA族元素,第二周期元素形成的氢化物中,H2O通常为液体,沸点最高,故折线n表示第ⅥA族元素氢化物的沸点变化,故H2S所在的折线为n,故答案为:n.
点评:本题考查元素的位置结构性质关系及应用,题目难度较大,本题从化合价角度来判断元素的种类,正确判断元素是解本题的关键,原子的杂化方式、分子的空间构型、氢键对物质沸点的影响是高考的热点,注意基础知识的积累.

练习册系列答案
相关题目
在下列反应中,水仅作还原剂的是( )
| A、Na2O+H2O═2NaOH | ||||
| B、2F2+2H2O═4HF+O2 | ||||
| C、Cl2+H2O═HCl+HClO | ||||
D、2H2O
|
已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-Q1 kJ?mol-1
2H2(g)+O2(g)═2H2O(g);△=-Q2 kJ?mol-1,
2H2(g)+O2(g)═2H2O(l);△H2=-Q3 kJ?mol-1
常温下,取体积比2:3的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为( )
2H2(g)+O2(g)═2H2O(g);△=-Q2 kJ?mol-1,
2H2(g)+O2(g)═2H2O(l);△H2=-Q3 kJ?mol-1
常温下,取体积比2:3的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为( )
| A、0.4Q1+0.15Q2 |
| B、0.2Q1+0.05Q2 |
| C、0.2Q1+0.15Q3 |
| D、0.2Q1+0.3Q2 |
下列说法正确的是(NA为阿伏加德罗常数)( )
| A、124g P4含有P-P键的个数为4NA |
| B、12g石墨中含有C-C键的个数为3NA |
| C、12g金刚石中含有C-C键的个数为2NA |
| D、60g SiO2中含Si-O键的个数为2NA |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、1 mol H2O所含有的原子数为NA |
| B、常温常压下,32g O2含有的氧原子数为2NA |
| C、常温常压下,11.2L氯气所含的分子数为NA |
| D、1L 0.1mol/L NaCl溶液中所含的Na+为NA |
下列离子方程式正确的是( )
| A、铜和硝酸银溶液反应:Cu+Ag+═Cu2++Ag |
| B、硫酸钠溶液和氢氧化钡溶液的反应:Ba2++SO42-═BaSO4 |
| C、铁和稀硫酸反应:2Fe2++6H+═2Fe3++3H2 |
| D、碳酸钙和稀盐酸反应:CO32-+2H+═CO2+H2O |
 乙基香兰素是目前国际公认的安全食用调香剂,广泛应用于各种需要增加奶香气息的调香食品中.其结构简式如图:
乙基香兰素是目前国际公认的安全食用调香剂,广泛应用于各种需要增加奶香气息的调香食品中.其结构简式如图: