题目内容
12.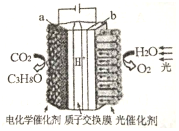 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O 和CO2转化为O2 和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O 和CO2转化为O2 和燃料(C3H8O).下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从b 极区向a 极区迁移 | |
| C. | 每生成1 mol O2,外电路有2 mol 电子转移 | |
| D. | a 电极的反应为:3CO2+18H+-18e--=C3H8O+5H2 O |
分析 A、该装置是电解池装置,是将电能转化为化学能;
B、与电源正极相连的是电解池的阳极,负极相连的是电解池的阴极,a与电源负极相连,所以a是阴极,而电解池中氢离子向阴极移动;
C、每生成1 mol O2,外电路有4mol 电子转移,由此分析解答;
D、a与电源负极相连,所以a是负极阴极,电极反应式为:3CO2+18H++18e-=C3H8O+5H2O.
解答 解:A、该装置是电解池装置,是将电能转化为化学能,所以该装置将光能和电能转化为化学能,故A错误;
B、a与电源负极相连,所以a是阴极,而电解池中氢离子向阴极移动,所以H+从阳极b极区向阴极a极区迁移,故B正确;
C、每生成1 mol O2,外电路有4mol 电子转移,故C错误;
D、a与电源负极相连,所以a是阴极,发生还原反应,电极反应式为:3CO2+18H++18e-=C3H8O+5H2O,故D错误;
故选B.
点评 本题考查电化学的相关知识,学生要清楚电解池的反应原理,阴极发生还原反应,阳极发生氧化反应,以及离子的移动方向就可以迅速解题了,比较容易.

练习册系列答案
相关题目
8.某学习小组探究铝粉与硝酸钠溶液在不同环境下的反应,进行了如下实验,根据实验过程回答相关问题:
(1)实验一
①初始未见明显现象的原因用离子方程式解释是6H++Al2O3═2Al3++3H2O.
②液面上方呈浅红棕色的原因用化学方程式解释是2NO+O2=2NO2.
③若步骤ⅲ按以下反应式发生,请完成该反应的离子方程式:I-+NO2=NO3-+NO↑+I2
(2)实验二
①步骤i中产生气泡的化学式是H2.
②步骤ⅱ中产生有刺激性气味气体的电子式是 .
.
③步骤ⅱ反应的离子方程式是8Al+3NO3-+5OH-+2H2O═3NH3↑+8AlO2-.
(3)从实验一、二说明,NO3?在酸性环境中具有氧化性,在碱性环境中具有强氧化性.
(1)实验一
| 装置 | 步骤 | 现象 |
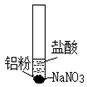 | ⅰ.取少量铝粉于试管,并加入盐酸 | 初始未见明显现象,一段时间后,冒出无色气泡. |
| ⅱ.在试管加入硝酸钠固体 | 继续冒出气泡,液面上方呈浅棕色,试管逐渐变热至沸腾. | |
| ⅲ.用湿润KI-淀粉试纸靠近试管口 | KI-淀粉试纸变蓝色. |
②液面上方呈浅红棕色的原因用化学方程式解释是2NO+O2=2NO2.
③若步骤ⅲ按以下反应式发生,请完成该反应的离子方程式:I-+NO2=NO3-+NO↑+I2
(2)实验二
| 装置 | 步骤 | 现象 |
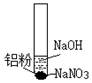 | ⅰ.取少量铝粉于试管,并加入氢氧化钠溶液 | 初始未见明显现象,一段时间后,冒无色气泡. |
| ⅱ.向试管中加入硝酸钠固体 | 继续冒出无色气泡,并有刺激性气味产生 | |
| ⅲ.用湿润红色石蕊试纸靠近试管口 | 试纸变蓝 | |
②步骤ⅱ中产生有刺激性气味气体的电子式是
 .
.③步骤ⅱ反应的离子方程式是8Al+3NO3-+5OH-+2H2O═3NH3↑+8AlO2-.
(3)从实验一、二说明,NO3?在酸性环境中具有氧化性,在碱性环境中具有强氧化性.
20.下列反应的离子方程式书写正确的是( )
| A. | CuCl2溶液与 Fe 的反应:Cu2++Fe═Cu+Fe3+ | |
| B. | 氯气与水反应:Cl2+H2O?H++Cl-+HClO | |
| C. | 氢氧化铝溶液与盐酸的反应:OH-+H+=H2O | |
| D. | 水垢中的CaCO3用CH3COOH溶液除去:CaCO3+2H+═Ca2++H2O+CO2↑ |
7.在一定条件下,将H2与CO2分别按n(H2):n(CO2)=1.5、2投入某恒压密闭容器中,发生反应:6H2+2CO2?C2H5OH+3H2O,测得不同温度时CO2的平衡转化率,呈如下两条曲线:

下列说法不正确的是( )

下列说法不正确的是( )
| A. | 达平衡时,6v(H2)正=2 v(CO2)逆 | B. | 正反应的反应热:△H<0 | ||
| C. | 平衡常数:Kb<Kc | D. | 曲线I的投料:n(H2):n(CO2)=2 |
17.汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
| A. | 转移电子的物质的量为1.25 mol | |
| B. | 生成42.0 L N2(标准状况) | |
| C. | 有0.250 mol KNO3被氧化 | |
| D. | 被还原的N原子的物质的量为3.75 mol |
4.炼油厂的废碱液含有废油、苯酚钠、碳酸钠等,实验室通过以下四个步骤处理废碱液获取氢氧化钠固体.下列说法正确的是( )
| A. | 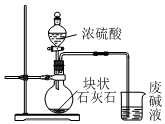 用装置甲制取CO2并通入废碱液 | |
| B. |  用装置乙从下口放出分液后上层的有机相 | |
| C. | 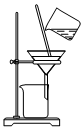 用装置丙分离水相中加入Ca(OH)2产生的CaCO3 | |
| D. |  用装置丁将滤液蒸发结晶得到NaOH固体 |
1.如图所示,甲池的总反应式为:N2H4+O2═N2+2H2O下列关于该电池工作时说法正确的是( )


| A. | 甲池中负极反应为:N2H4-4e-═N2+4H+ | |
| B. | 甲池溶液pH不变,乙池溶液pH减小 | |
| C. | 反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度 | |
| D. | 甲池中消耗2.24L O2,此时乙池中理论上最多产生12.8g固体 |
2.下列说法正确的是( )
| A. | 手机外壳上贴的碳纤维外膜是一种新型的有机高分子材料 | |
| B. | 绿色化学的核心是对环境产生的污染进行治理 | |
| C. | 氯化铵、二氧化硫溶于水都能导电,所以它们都属于电解质 | |
| D. | 云、烟、雾等均能产生丁达尔现象 |
 ,Q3Y2与水可剧烈反应,反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑
,Q3Y2与水可剧烈反应,反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑