题目内容
15.现有灼烧了一段时间的碳酸钙样品16 g,将其溶于足量的水中,向其中通入适量的二氧化碳,过滤,再次将所得的固体灼烧至质量不变,所得固体质量11.2 g,则原固体混合物中钙元素的质量分数为( )| A. | 50% | B. | 40% | C. | 60% | D. | 70% |
分析 发生CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、Ca(OH)2+CO2=CaCO3↓+H2O,则最终固体11.2g为CaO,Ca在整个过程中没有损失,结合Ca原子守恒计算.
解答 解:灼烧时发生CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,溶于足量的水中,向其中通入适量的二氧化碳发生Ca(OH)2+CO2=CaCO3↓+H2O,
再次将所得的固体灼烧发生CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,
则最终固体11.2g为CaO,Ca在整个过程中没有损失,
由Ca原子守恒可知原固体混合物中钙元素的质量分数为$\frac{\frac{11.2g}{56g/mol}×40g/mol}{16g}$×100%=50%,
故选A.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应、原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
5.下列关于反应能量的说法正确的是( )
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量>生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则含1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
3.下列有关离子共存或者反应的离子方程式正确的是( )
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-能共存 | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-能共存 | |
| C. | 0.01mol/LNH4Al(SO4)2溶液与0.01mol/LBa(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 二氧化硫通入次氯酸钠碱性溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O |
10.已知H2(g)+Cl2(g)═2HCl(g)△H=-184.6KJ•mol-1,则HCl(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g) 的△H 为( )
| A. | +184.6KJ•mol-1 | B. | 92.3KJ•mol-1 | C. | -369.2KJ•mol-1 | D. | +92.3KJ•mol-1 |
7.关于有机物的下列说法,错误的是( )
| A. | 石油裂解能得到乙烯,乙烯是生产聚乙烯的原料 | |
| B. | 甲烷、苯都属于烃,都不存在同分异构体 | |
| C. | 点燃甲烷前一定要检验其纯度 | |
| D. | 煤干馏为化学变化,石油分馏是物理变化 |
4.下列不属于人体必需元素的是( )
| A. | F | B. | N | C. | Zn | D. | Al |
5.下列反应中,属于加成反应的是( )
| A. | CH3CH3+Br2→CH3CH2Br+HBr | |
| B. | 2CH3CHO+O2 $→_{△}^{催化剂}$ 2CH3COOH | |
| C. | CH3CH=CH2+Br2→CH3CHBr-CH2Br | |
| D. | 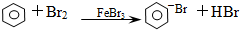 |





 .
.