题目内容
9.下列操作不能在氧化铝坩埚中进行的是( )| A. | 加热NH4HCO3 | B. | 煅烧海带 | C. | 熔化烧碱 | D. | 加热NaCl |
分析 氧化铝为两性氧化物,既能与酸反应又能与碱反应,故能与烧碱NaOH反应,则烧碱的熔化不能在氧化铝坩埚中进行,而氧化铝与NH4HCO3、NaCl和海带不反应,据此进行解答.
解答 解:A.加热分解NH4HCO3,NH4HCO3不与氧化铝反应,可以在在氧化铝坩埚中进行,故A不选;
B.海带不与氧化铝反应,可以在氧化铝坩埚中煅烧海带,故B不选;
C.烧碱为氢氧化钠,NaOH与氧化铝反应生成偏铝酸钠和水,所以不能在氧化铝坩埚中进行,故C选;
D.氯化钠与氧化铝不反应,可以在氧化铝坩埚中加热NaCl,故D不选;
故选C.
点评 本题考查了常见元素化合物的性质,题目难度不大,明确氧化铝的性质解答本题的关键,注意掌握常见元素及其化合物性质,试题培养了学生的灵活应用能力.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
2.下列措施对增大反应速率明显有效的是( )
| A. | Na与水反应时增大水的用量 | |
| B. | Fe与稀硫酸反应制取H2时,改用浓硫酸 | |
| C. | 在K2SO4与BaCl2两溶液反应时,增大反应容器体积 | |
| D. | Al在氧气中燃烧生成Al2O3,将Al片改成Al粉 |
2.己烷雌酚的一种合成路线如图:

下列叙述不正确的是( )

下列叙述不正确的是( )
| A. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| B. | 在一定条件,化合物Y可与HCHO发生缩聚反应 | |
| C. | 用FeCl3溶液可鉴别化合物X和Y | |
| D. | 化合物Y中含有手性碳原子 |
17.如图是利用一种微生物将废水中的有机物(假设是淀粉)的化学能直接转化为电能,并利用此电能在铁上镀铜,下列说法中正确的是( )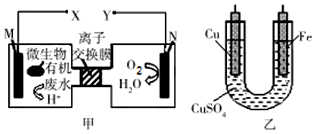

| A. | M电极反应式:(C6H10O5)n+7nH2O-24ne-═6nCO2↑+24nH+ | |
| B. | 铜电极应与X相连接 | |
| C. | 质子透过离子交换膜由右向左移动 | |
| D. | 当N电极消耗0.2 mol气体时,则铁电极增重16g |
14.已知一定温度下合成氨反应:N2+H2═2NH3 (每生成2mol NH3放出92.4kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1mol N2和3mol H2,达平衡时放出热量为Q1,②通入2mol N2和6mol H2,达平衡时放出热量为Q2,则下列关系正确的是( )
| A. | Q2>2 Q1 | B. | Q1=92.4 kJ | C. | Q1<Q2<184.8 kJ | D. | Q1=Q2<92.4 kJ |
2. 已知下列数据:
已知下列数据:
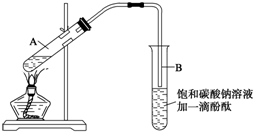
学生在实验室制取乙酸乙酯的主要步骤如下:
①在30mL的大试管A中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合溶液;
②按下图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10min;
③待试管B收集到一定量的产物后停止加热,撤去试管B并用力振荡,然后静置待分层;
④分离出乙酸乙酯层、洗涤、干燥.
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为在大试管中先加4mL乙醇,再缓慢加入1mL浓H2SO4,边加边振荡,待冷至室温后,再加4mL乙酸并摇匀写出制取乙酸乙酯的化学方程式:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O
(2)上述实验中饱和碳酸钠溶液的作用是(填字母)BC.
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热操作,其主要理由是防止反应物随生成物一起大量被蒸出来,导致原料损失及发生副反应
(4)分离出乙酸乙酯后,为了干燥乙酸乙酯可选用的干燥剂为(填字母)B.
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH固体.
 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
①在30mL的大试管A中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合溶液;
②按下图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10min;
③待试管B收集到一定量的产物后停止加热,撤去试管B并用力振荡,然后静置待分层;
④分离出乙酸乙酯层、洗涤、干燥.
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为在大试管中先加4mL乙醇,再缓慢加入1mL浓H2SO4,边加边振荡,待冷至室温后,再加4mL乙酸并摇匀写出制取乙酸乙酯的化学方程式:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O
(2)上述实验中饱和碳酸钠溶液的作用是(填字母)BC.
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热操作,其主要理由是防止反应物随生成物一起大量被蒸出来,导致原料损失及发生副反应
(4)分离出乙酸乙酯后,为了干燥乙酸乙酯可选用的干燥剂为(填字母)B.
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH固体.
 :2Ag + 2H+=2Ag+ + H2↑
:2Ag + 2H+=2Ag+ + H2↑