题目内容
2. 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
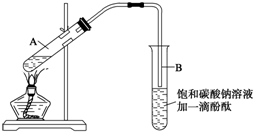
①在30mL的大试管A中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合溶液;
②按下图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10min;
③待试管B收集到一定量的产物后停止加热,撤去试管B并用力振荡,然后静置待分层;
④分离出乙酸乙酯层、洗涤、干燥.
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为在大试管中先加4mL乙醇,再缓慢加入1mL浓H2SO4,边加边振荡,待冷至室温后,再加4mL乙酸并摇匀写出制取乙酸乙酯的化学方程式:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O
(2)上述实验中饱和碳酸钠溶液的作用是(填字母)BC.
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热操作,其主要理由是防止反应物随生成物一起大量被蒸出来,导致原料损失及发生副反应
(4)分离出乙酸乙酯后,为了干燥乙酸乙酯可选用的干燥剂为(填字母)B.
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH固体.
分析 (1)乙酸和乙醇在浓硫酸的催化作用下反应生成乙酸乙酯和水;
(2)乙酸具有酸性,能和饱和碳酸钠溶液反应而把被吸收,乙酸乙酯在饱和碳酸钠溶液中的溶解度较小;
(3)乙醇、乙酸的沸点较低,易挥发;
(4)干燥乙酸乙酯,用无水硫酸钠除去少量的水,无水硫酸钠吸水形成硫酸钠结晶水合物.
解答 解:(1)乙酸和乙醇在浓硫酸的催化作用下反应生成乙酸乙酯和水,其反应方程式为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
(2)乙酸具有酸性,能和饱和碳酸钠溶液反应而把被吸收,乙酸乙酯在饱和碳酸钠溶液中的溶解度较小,易于分离,
故答案为:BC;
(3)反应物中乙醇、乙酸的沸点较低,若用大火加热,大量反应物随产物蒸发而损失原料,温度过高还可能发生其他副反应,所以为防止乙醇、乙酸挥发,造成原料的损失,应小火加热,
故答案为:防止反应物随生成物一起大量被蒸出来,导致原料损失及发生副反应;
(4)干燥乙酸乙酯,用无水硫酸钠除去少量的水,无水硫酸钠吸水形成硫酸钠结晶水合物;不能选择P2O5、碱石灰和NaOH等固体干燥剂,以防乙酸乙酯在酸性(P2O5遇水生成酸)或碱性条件下水解.
故答案为:B.
点评 本题主要考查了乙酸乙酯的制备,掌握乙酸乙酯的制备原理,以及运用原理理解实验装置的改进创新思路是解答的关键,题目难度中等.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
9.下列操作不能在氧化铝坩埚中进行的是( )
| A. | 加热NH4HCO3 | B. | 煅烧海带 | C. | 熔化烧碱 | D. | 加热NaCl |
12.四种有机物A、B、C、D分子式均为C3H6O2,把它们分别进行实验并记录现象如下:
四种物质的结构简式为:
ACH3CH2COOH BCH3CHOHCHO或CH2OHCH2CHOCHCOOCH2CH3 DCH3COOCH3.
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
| A | 发生中和反应 | 不反应 | 溶解 | 生成氢气 |
| B | 不反应 | 有银镜反应 | 有红色沉淀 | 放出氢气 |
| C | 发生水解反应 | 有银镜反应 | 有红色沉淀 | 不反应 |
| D | 发生水解反应 | 不反应 | 不反应 | 不反应 |
ACH3CH2COOH BCH3CHOHCHO或CH2OHCH2CHOCHCOOCH2CH3 DCH3COOCH3.
 Z(g)+W(s);△H>0,下列叙述正确的是
Z(g)+W(s);△H>0,下列叙述正确的是 H2(g)+Br2(g),下列四个图中可以表示该反应在一定条件下为可逆反应的是
H2(g)+Br2(g),下列四个图中可以表示该反应在一定条件下为可逆反应的是 B.
B. C.
C. D.
D.
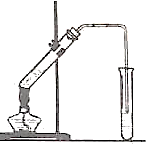 如图,在左试管中先加入2mL95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.
如图,在左试管中先加入2mL95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.