题目内容
下列实验能达到目的是( )
| A、浓氨水滴进碱石灰里可制得氨气 |
| B、锌片与稀硝酸反应可制得氢气 |
| C、用乙醇萃取碘水中的碘单质 |
| D、SO2通入溴水,验证SO2的漂白性 |
考点:氨的化学性质,硝酸的化学性质,二氧化硫的化学性质,物质的分离、提纯和除杂
专题:
分析:A、氢氧化钠溶于水放出大量的热量,而氨气易挥发,则浓氨水滴入氢氧化钠固体里可制得氨气;
B、稀硝酸的强氧化性,生成一氧化氮;
C、乙醇与水互溶;
D、SO2通入溴水,发生氧化还原而褪色.
B、稀硝酸的强氧化性,生成一氧化氮;
C、乙醇与水互溶;
D、SO2通入溴水,发生氧化还原而褪色.
解答:
解:A、氢氧化钠溶于水放出大量的热量,而氨气易挥发,则浓氨水滴入氢氧化钠固体里可制得氨气,故A正确;
B、稀硝酸的强氧化性,生成一氧化氮,不生成氢气,故B错误;
C、乙醇与水互溶,所以不能用乙醇萃取碘水中的碘单质,故C错误;
D、SO2通入溴水,发生氧化还原而褪色,说明二氧化硫的还原性,故D错误;
故选A.
B、稀硝酸的强氧化性,生成一氧化氮,不生成氢气,故B错误;
C、乙醇与水互溶,所以不能用乙醇萃取碘水中的碘单质,故C错误;
D、SO2通入溴水,发生氧化还原而褪色,说明二氧化硫的还原性,故D错误;
故选A.
点评:本题综合考查氨气、硝酸的性质,为高频考点,侧重于基础知识的考查,注意把握氨气与碱石灰混合的特点,难度不大.

练习册系列答案
相关题目
一定量Na2O2与一定量的CO2反应后的固体物质18.4g,恰好与400mL 1mol?L-1的稀盐酸完全反应,以下说法合理的是(NA表示阿伏伽德罗常数)( )
| A、反应中电子转移数为0.2NA |
| B、一定量的CO2为0.1NA |
| C、18.4 g固体物质为0.1mol Na2CO3和0.1molNa2O2的混合物 |
| D、一定量的Na2O2为0.1mol |
化学与环境、生产和生活密切相关.下列说法错误的是( )
| A、干冰可以用于人工降雨 |
| B、推广使用可降解塑料,有助于减少“白色污染” |
| C、将熟石灰和硝酸铵混合施用,肥效更高 |
| D、环境保护应从源头消除污染 |
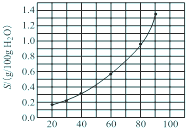 溴酸银(AgBrO3)的溶解度随温度变化曲线如图所示,下列说法错误的是( )
溴酸银(AgBrO3)的溶解度随温度变化曲线如图所示,下列说法错误的是( )| A、温度升高时溴酸银溶解速度加快 |
| B、溴酸银的溶解是放热过程 |
| C、60℃时,溴酸银的Ksp约等于6×10-4 |
| D、常温下溴酸银微溶于水 |
应用元素周期律分析下列推断,其中正确的是( )
| A、酸性强弱:HClO>H2SO4>H2CO3 |
| B、热稳定性:HF>HCl>HBr |
| C、已知硒(Se)与硫同主族,其最高价氧化物对应的水化物分子式为:H2SeO3 |
| D、原子半径大小:Na>P>N |
将一定质量的锌粉与100mL 18.5mol?L-1的浓H2SO4混合,充分反应后锌完全溶解,生成了标准状况下的混合气体33.6L(设浓H2SO4的还原产物只有SO2,稀硫酸只生成H2),将反应后的溶液稀释成1L时,溶液pH=1,参加反应的锌为( )
| A、0.9 mol |
| B、1.2 mol |
| C、1.5 mol |
| D、1.8 mol |
含有下列各组离子的溶液中通入(或加入)过量的某种物质后仍能大量共存的是( )
| A、H+、Ba2+、Fe3+、NO3-,通入SO2气体 |
| B、Ca2+、Cl-、K+、H+,通入CO2气体 |
| C、AlO2-、Na+、Br-、SO42-,通入CO2气体 |
| D、HCO3-、Na+、I-、HS-,加入AlCl3溶液 |
 e.
e. f.
f.