题目内容
用于合成氨的工业煤气中含有H2S、C2H5SH(乙硫醇)、COS(羰基硫)、CS2等含硫化合物,工业上无机硫常用ZnO法处理,处理后的产物中含有CH4、C2H6、C2H4、CO等物质.有机硫可用钴钼催化加氢处理.
(1)下列说法正确的是 (填字母).
A.C2H4分子中有4个σ键和1个π键
B.H2S分子呈V形结构
C.COS、CH4、C2H6分子中碳原子分别采用sp2、sp3、sp3杂化
D.相同压强下沸点:CS2>CO2
E.相同压强下沸点:C2H5SH>C2H5OH
F.相同压强下沸点:CO>N2
(2)β-ZnS的晶胞结构如右图15,晶胞中S2-数目为 个.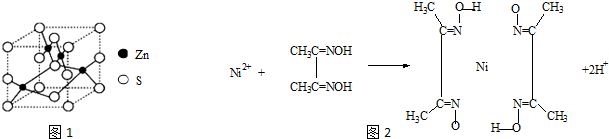
(3)具有相似晶胞结构的ZnS和ZnO,ZnS熔点为1830℃,ZnO熔点为1975℃,后者较前者高是由
于 .
(4)雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得.实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀.
①Ni2+在基态时,核外电子排布式为: .
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为4).
(1)下列说法正确的是
A.C2H4分子中有4个σ键和1个π键
B.H2S分子呈V形结构
C.COS、CH4、C2H6分子中碳原子分别采用sp2、sp3、sp3杂化
D.相同压强下沸点:CS2>CO2
E.相同压强下沸点:C2H5SH>C2H5OH
F.相同压强下沸点:CO>N2
(2)β-ZnS的晶胞结构如右图15,晶胞中S2-数目为

(3)具有相似晶胞结构的ZnS和ZnO,ZnS熔点为1830℃,ZnO熔点为1975℃,后者较前者高是由
于
(4)雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得.实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀.
①Ni2+在基态时,核外电子排布式为:
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为4).
考点:配合物的成键情况,元素周期律的作用,不同晶体的结构微粒及微粒间作用力的区别
专题:
分析:(1)A.共价单键为σ键,共价双键中一个是σ键、一个是π键;
B.根据价层电子对互斥理论确定分子的空间构型,H2S的中心原子含有2个共用电子对和2个孤电子对,则H2S分子呈V形结构;
C.COS的中心原子价层电子对数为2,采取sp杂化,甲烷分子和乙烷分子中,每个碳原子都含有4个共价单键,所以CH4、C2H6分子中碳原子均采用sp3杂化;
D.CS2、CO2属于分子晶体,相对分子质量越大,分子间作用力越大,相同压强下沸点越高;
E.C2H5OH分子间能形成氢键,氢键是一种比范德华力更强的分子间作用力,可显著增大物质的沸点;
F.CO和N2是等电子体,CO为极性分子,N2是非极性分子,极性分子的沸点高于非极性分子的沸点;
(2)利用均摊法计算硫离子的数目,根据图知,硫处于8个顶点、4条棱边、2个面心,1个体心,因此硫离子个数=8×
+4×
+2×
+1×1=4;
(3)具有相似晶胞结构的ZnS和ZnO,ZnS熔点为1830℃,ZnO熔点为1975℃,熔点大小与离子晶体的晶格能成正比,晶格能与离子半径成反比;
(4)①根据核外电子排布规律书写,注意原子形成阳离子先失去高能层的电子;
②Ni2+含有空轨道,N原子含有孤对电子对,N原子与Ni2+形成配位键,氧原子与氢原子之间形成氢键.
B.根据价层电子对互斥理论确定分子的空间构型,H2S的中心原子含有2个共用电子对和2个孤电子对,则H2S分子呈V形结构;
C.COS的中心原子价层电子对数为2,采取sp杂化,甲烷分子和乙烷分子中,每个碳原子都含有4个共价单键,所以CH4、C2H6分子中碳原子均采用sp3杂化;
D.CS2、CO2属于分子晶体,相对分子质量越大,分子间作用力越大,相同压强下沸点越高;
E.C2H5OH分子间能形成氢键,氢键是一种比范德华力更强的分子间作用力,可显著增大物质的沸点;
F.CO和N2是等电子体,CO为极性分子,N2是非极性分子,极性分子的沸点高于非极性分子的沸点;
(2)利用均摊法计算硫离子的数目,根据图知,硫处于8个顶点、4条棱边、2个面心,1个体心,因此硫离子个数=8×
| 1 |
| 8 |
| 1 |
| 4 |
| 1 |
| 2 |
(3)具有相似晶胞结构的ZnS和ZnO,ZnS熔点为1830℃,ZnO熔点为1975℃,熔点大小与离子晶体的晶格能成正比,晶格能与离子半径成反比;
(4)①根据核外电子排布规律书写,注意原子形成阳离子先失去高能层的电子;
②Ni2+含有空轨道,N原子含有孤对电子对,N原子与Ni2+形成配位键,氧原子与氢原子之间形成氢键.
解答:
解:(1)A.共价单键为σ键,共价双键中一个是σ键、一个是π键,C2H4分子中有5个σ键和1个π键,故A错误;
B.H2S分子中,硫原子中含有2个共用电子对和2个孤电子对,则H2S分子呈V形结构,故B正确;
C.COS的中心原子价层电子对数为2,采取sp杂化,甲烷分子和乙烷分子中,每个碳原子都含有4个共价单键,所以CH4、C2H6分子中碳原子均采用sp3杂化,故C错误;
D.CS2、CO2属于分子晶体,CS2的相对分子质量大于CO2,因此相同压强下沸点:CS2>CO2,故D正确;
E.C2H5SH的范德华力比大,但C2H5OH分子间能形成氢键,氢键是一种比范德华力更强的分子间作用力,可显著增大物质的沸点,因此相同压强下沸点:C2H5SH<C2H5OH,故E错误;
F.CO和N2是等电子体,等电子体的沸点于分子极性有关,CO为极性分子,N2是非极性分子,极性分子的沸点高于非极性分子的沸点,故F正确;
故选BDF;
(2)根据图知,硫处于8个顶点、4条棱边、2个面心,1个体心,因此硫离子个数=8×
+4×
+2×
+1×1=4,
故答案为:4;
(3)离子晶体的熔点与晶格能成正比,晶格能与离子半径成反比,氧化锌和硫化锌中,氧离子半径小于硫离子,所以氧化锌的晶格能大于硫化锌,则氧化性的熔点高于硫化锌,
故答案为:氧离子半径比硫离子小,晶格能大;
(4)①Ni原子核外电子排布为1s22s22p63s23p63d84s2,失去4s能级的2个电子形成Ni2+,基态时Ni2+核外电子排布式为1s22s22p63s23p63d8,
故答案为:1s22s22p63s23p63d8;
②Ni2+含有空轨道,N原子含有孤对电子对,N原子与Ni2+形成配位键,不同分子中氧原子与氢原子之间形成氢键,如图所示: ,
,
故答案为: .
.
B.H2S分子中,硫原子中含有2个共用电子对和2个孤电子对,则H2S分子呈V形结构,故B正确;
C.COS的中心原子价层电子对数为2,采取sp杂化,甲烷分子和乙烷分子中,每个碳原子都含有4个共价单键,所以CH4、C2H6分子中碳原子均采用sp3杂化,故C错误;
D.CS2、CO2属于分子晶体,CS2的相对分子质量大于CO2,因此相同压强下沸点:CS2>CO2,故D正确;
E.C2H5SH的范德华力比大,但C2H5OH分子间能形成氢键,氢键是一种比范德华力更强的分子间作用力,可显著增大物质的沸点,因此相同压强下沸点:C2H5SH<C2H5OH,故E错误;
F.CO和N2是等电子体,等电子体的沸点于分子极性有关,CO为极性分子,N2是非极性分子,极性分子的沸点高于非极性分子的沸点,故F正确;
故选BDF;
(2)根据图知,硫处于8个顶点、4条棱边、2个面心,1个体心,因此硫离子个数=8×
| 1 |
| 8 |
| 1 |
| 4 |
| 1 |
| 2 |
故答案为:4;
(3)离子晶体的熔点与晶格能成正比,晶格能与离子半径成反比,氧化锌和硫化锌中,氧离子半径小于硫离子,所以氧化锌的晶格能大于硫化锌,则氧化性的熔点高于硫化锌,
故答案为:氧离子半径比硫离子小,晶格能大;
(4)①Ni原子核外电子排布为1s22s22p63s23p63d84s2,失去4s能级的2个电子形成Ni2+,基态时Ni2+核外电子排布式为1s22s22p63s23p63d8,
故答案为:1s22s22p63s23p63d8;
②Ni2+含有空轨道,N原子含有孤对电子对,N原子与Ni2+形成配位键,不同分子中氧原子与氢原子之间形成氢键,如图所示:
 ,
,故答案为:
 .
.
点评:本题考查物质结构和性质,涉及知识点较多,题目综合性较大,考查知识点有化学键、杂化轨道、核外电子排布规律、晶体类型及物理性质比较、晶胞的计算等,同时考查学生空间想象能力、知识运用能力.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
下列有关说法正确的是( )
A、以下是精确配制一定物质的量浓度NaOH溶液的实验步骤,其中操作正确的有4步 |
| B、苯的硝化实验三种溶液混合过程中,应先在试管中加入浓硝酸,再沿试管壁缓慢加入浓硫酸混合均匀,冷却到50℃以下,再在不断振荡下逐滴加入苯 |
| C、火柴头中硫元素的检测实验中,应用少量1mol?L-1较大浓度的高锰酸钾溶液来吸收SO2气体,以便于观察到褪色的明显实验现象 |
| D、在试管中加入2mL硝酸银溶液,然后加入几滴NaCl溶液,再加入几滴KI溶液,可以观察到白色沉淀变成黄色沉淀,可以说明AgI的KSP小于AgCl的KSP |
 一定条件下,在绝热恒容2L密闭容器中进行反应:N2(g)+3H2(g)?2NH3(g)+Q,若反应过程中n(H2)和n(NH3)随时间变化的关系如图所示,则下列有关叙述中一定正确的是( )
一定条件下,在绝热恒容2L密闭容器中进行反应:N2(g)+3H2(g)?2NH3(g)+Q,若反应过程中n(H2)和n(NH3)随时间变化的关系如图所示,则下列有关叙述中一定正确的是( )| A、若在t2时刻再充入一定量He,达平衡时C(H2)<0.4mol/L |
| B、a点表示NH3生成速率与NH3分解速率相等 |
| C、b点和c点H2的转化率相等 |
| D、若在t1时刻再充入一定量H2,达平衡时化学平衡常数变小 |
下列物质在足量氧气中燃烧,能生成黑色固体的是( )
| A、铁丝 | B、红磷 | C、酒精 | D、木炭 |
下列实验能达到目的是( )
| A、浓氨水滴进碱石灰里可制得氨气 |
| B、锌片与稀硝酸反应可制得氢气 |
| C、用乙醇萃取碘水中的碘单质 |
| D、SO2通入溴水,验证SO2的漂白性 |


 (R、R′代表烷基或H原子)发生缩合反应生成新的有机物和水.苯酚还能发生如下反应生成有机酸酯:
(R、R′代表烷基或H原子)发生缩合反应生成新的有机物和水.苯酚还能发生如下反应生成有机酸酯:

 反应合成聚碳酸酯的化学方程式:
反应合成聚碳酸酯的化学方程式: 的同分异构体与新制银氨溶液发生反应的化学方程式:
的同分异构体与新制银氨溶液发生反应的化学方程式: