题目内容
8.已知在酸性溶液中,下列物质氧化H2S生成S是时,自身发生如下变化:IO3-→I2; Fe3+→Fe2+; SO2→S;MnO4-→Mn2+.如果分别用等物质的量的这些物质氧化足量的H2S,得到S最多的是( )| A. | IO3- | B. | Fe3+ | C. | SO2 | D. | MnO4- |
分析 等物质的量的氧化剂得到电子越多,消耗硫化氢的量越多,生成硫单质越大,以此来解答.
解答 解:由氧化还原反应中得失电子守恒,1mol氧化剂得电子越多,生成的I2就多;
A、1molIO3-→I2得5mole-,生成2.5molS;
B、1molFe3+→Fe2+得1mole-,生成0.5molS;
C、1molSO2→S得4mole-,同时消耗2molH2S,共生成3molS;
D、1molMnO4-→Mn2+得5mole-,生成2.5molS;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应转移电子的计算,题目难度不大.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目
19. 在如图用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )
在如图用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )
 在如图用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )
在如图用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )| A. | 锌片是正极,铜片上有气泡产生 | |
| B. | 电流方向是从锌片流向铜片 | |
| C. | 溶液中的阳离子向正极移动,阴离子向负极移动 | |
| D. | 电解液的PH值逐渐减少 |
16.下列叙述正确的是( )
| A. | Cl2+2Br-═2Cl-+Br2、Zn+Cu2+═Zn2++Cu均为单质被还原的置换反应 | |
| B. | 2Na2O2+2H2O═4NaOH+O2↑、Cl2+H2O═HCl+HClO均为水作还原剂的氧化还原反应 | |
| C. | Cl元素的单质在化学反应中只表现氧化性 | |
| D. | NaSO3与H2O2的反应为氧化还原反应 |
3.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 25℃,pH=12的NaOH溶液中含有OH-的数目为0.01 NA | |
| B. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,在该反应中,当有3NA电子转移时,上述热化学反应方程式的焓变为△H=-46.2KJ/mol | |
| C. | 2.3g金属钠与过量氧气充分反应,无论加热与否转移电子数为0.1NA | |
| D. | 50mL 18.4mo1/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
13.下列推断正确的是(( )
| A. | SiO2是酸性氧化物,能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | CO2,SO2排放到空气中都能形成酸雨,应严格控制排放 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
17.下列物质性质与应用对应关系正确的是( )
| A. | 二氧化锰具有还原性,可用于实验室制备氯气 | |
| B. | Na2O2能与水或二氧化碳反应生成氧气,可用作供氧剂 | |
| C. | 碳酸氢钠能与碱反应,可用作食品的膨松剂 | |
| D. | SO2具有漂白性,可用标准KMnO4溶液滴定食品中SO2残留量 |
1.常温下,向20升真空容器内通入a 摩硫化氢和b 摩二氧化硫,反应完全后,容器内气体密度最小时的硫化氢与二氧化硫的物质的量的比是( )
| A. | 2:1 | B. | 1:2 | C. | 2:3 | D. | 3:2 |
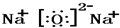 .
.