题目内容
17.下列物质性质与应用对应关系正确的是( )| A. | 二氧化锰具有还原性,可用于实验室制备氯气 | |
| B. | Na2O2能与水或二氧化碳反应生成氧气,可用作供氧剂 | |
| C. | 碳酸氢钠能与碱反应,可用作食品的膨松剂 | |
| D. | SO2具有漂白性,可用标准KMnO4溶液滴定食品中SO2残留量 |
分析 A.二氧化锰具有氧化性,实验室制备氯气的反应中,二氧化锰表现了氧化性;
B.过氧化钠与水、二氧化碳反应生成氧气,可作供养剂;
C.碳酸氢钠与酸反应生成二氧化碳气体,可作食品的膨松剂;
D.二氧化硫被酸性高锰酸钾溶液溶液发生氧化还原反应,二氧化硫表现了还原性.
解答 解:A.实验室制备氯气的反应中,二氧化锰作氧化剂,表现了氧化性,故A错误;
B.Na2O2能与水、二氧化碳反应都能够生成氧气,故过氧化钠可用作供氧剂,故B正确;
C.碳酸氢钠能与碱反应不会生成气体,碳酸氢钠与酸反应生成二氧化碳,则可用作食品的膨松剂,故C错误;
D.可用标准KMnO4溶液滴定食品中SO2残留量,利用的是二氧化硫的还原性,不是漂白性,故D错误;
故选B.
点评 本题考查了物质组成、结构与性质的关系,题目难度不大,涉及氧化还原反应、钠的化合物性质及用途、二氧化硫的性质等知识,明确常见元素及其化合物性质为解答关键,试题培养了学生的灵活应用基础知识的能力.

练习册系列答案
相关题目
8.已知在酸性溶液中,下列物质氧化H2S生成S是时,自身发生如下变化:IO3-→I2; Fe3+→Fe2+; SO2→S;MnO4-→Mn2+.如果分别用等物质的量的这些物质氧化足量的H2S,得到S最多的是( )
| A. | IO3- | B. | Fe3+ | C. | SO2 | D. | MnO4- |
12.下列物质既含共价键,又含离子键的是( )
| A. | CO | B. | CaF2 | C. | CH4 | D. | NH4Cl |
2.2013年8月6日,中欧光伏产业谈判协议正式生效,为我国乃至世界新能源的发展起到极大的推动作用,晶体硅是光伏产业的重要材料.下列说法正确的是( )
| A. | 硅不能作为新能源开发的材料 | B. | 硅不可能与同主族的碳形成化合物 | ||
| C. | 二氧化硅属于离子化合物 | D. | 获取新能源不一定要发生化学变化 |
9.a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c.下列叙述错误的是( )
| A. | d元素的非金属性最强 | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | a的最高价氧化物对应的水化物是强碱 | |
| D. | b、c、d的气态氢化物的稳定性:b>c>d |
10.对于反应:N2+O2?2NO,在密闭容器中进行,下列条件中能减慢化学反应速率的是(假设温度不变)( )
| A. | 缩小体积使压强增大 | B. | 体积不变充入N2使气体压强增大 | ||
| C. | 体积不变充入He使气体压强增大 | D. | 压强不变,充入He使体积增大 |
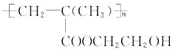 ,它是制作软质隐形眼镜的材料.请写出下列有关反应的化学方程式:
,它是制作软质隐形眼镜的材料.请写出下列有关反应的化学方程式: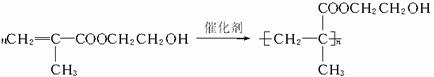 .
.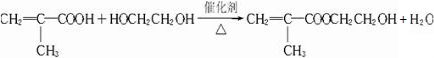 .
. .
.