题目内容
20.将Na、Mg、Al三种金属各0.3mol分别投入100ml 0.5mol/L稀硫酸中充分反应,则在标准状况下生成的氢气的体积比是( )| A. | 1:1:1 | B. | 1:2:3 | C. | 3:1:1 | D. | 6:3:2 |
分析 n(硫酸)=0.1L×0.5mol/L=0.05mol,则n(H+)=0.05mol×2=0.1mol,Na、Mg、Al三种金属各0.3mol,可知金属均过量,以此来解答.
解答 解:n(硫酸)=0.1L×0.5mol/L=0.05mol,则n(H+)=0.05mol×2=0.1mol,H得到电子为0.1mol,
Na、Mg、Al三种金属各0.3mol,若完全反应,失去电子分别为0.3mol、0.6mol、0.9mol,
可知金属均过量,酸不足,酸完全反应,则生成氢气相同,在标准状况下生成的氢气的体积比是1:1:1,
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握物质的量计算、电子守恒为解答的关键,侧重分析与计算能力的考查,注意过量判断,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.下列叙述中正确的是( )
| A. | 任何条件下,等物质的量 的水和一氧化碳所含有的分子数必相等 | |
| B. | 同温同压下,相同体积的物质,它们的物质的量必相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 1mol任何气体所占的体积都约为22.4L |
11.下列对有机物结构或性质的描述,错误的是( )
| A. | 苯分子中的6个碳原子之间的键完全相同,是一种介于碳碳单键和碳碳双键之间独特的键 | |
| B. | 将溴水加入苯中,溴水的颜色变浅,这是由于发生了加成反应 | |
| C. | 乙烷和丙烯的物质的最共1mol,完全燃烧后生成3molH2O | |
| D. | 主链上有5个碳原子的庚烷有5 种同分异构体 |
8.卢瑟福的α粒子散射实验的现象说明了( )
①葡萄干面包原子模型的理论是错误的
②原子中绝大部分都是空的
③原子中存在着很小的带正电荷的核.
①葡萄干面包原子模型的理论是错误的
②原子中绝大部分都是空的
③原子中存在着很小的带正电荷的核.
| A. | ①②③ | B. | ②③ | C. | ①③ | D. | ①② |
15.硅是信息高速公路的基石,通常以硅石(SiO2>99.0%、还有少量的Al2O3、Fe2O3等)为主要原料制备,主要流程如图所示.
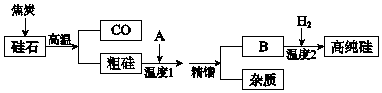
(1)从硅石中得到粗硅的化学方程式是SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,粗硅含有的杂质有铝、铁等.
(2)二氧化硅与焦炭在高温下也能得到一种硬度仅次于金刚石的物质金刚砂(化学式为SiC,Si为+4价),原理是SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑,该反应中的氧化剂是碳.
(3)若A是氯气,B是四氯化硅,精馏得到纯净SiCl4,温度应控制的范围是a(填序号).
a.55~60℃b.180~200℃c.300~320℃
则精馏分离出的杂质成分是FeCl3、AlCl3.
(4)若A是HCl,B是SiHCl3,生产过程中可循环利用的物质是HCl.

(1)从硅石中得到粗硅的化学方程式是SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,粗硅含有的杂质有铝、铁等.
(2)二氧化硅与焦炭在高温下也能得到一种硬度仅次于金刚石的物质金刚砂(化学式为SiC,Si为+4价),原理是SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑,该反应中的氧化剂是碳.
(3)若A是氯气,B是四氯化硅,精馏得到纯净SiCl4,温度应控制的范围是a(填序号).
| 物质 | SiCl4 | SiHCl3 | FeCl3 | AlCl3 |
| 熔点/℃ | -70 | -128.2 | 306 | -- |
| 沸点/℃ | 57.6 | 31.85 | 315 | 181 升华 |
则精馏分离出的杂质成分是FeCl3、AlCl3.
(4)若A是HCl,B是SiHCl3,生产过程中可循环利用的物质是HCl.
5.一定量的钠、镁、铝分别与足量盐酸反应,放出的氢气的物质的量相等,则钠、镁、铝三种金属的物质的量之比为( )
| A. | 1:1:1 | B. | 4:2:1 | C. | 2:3:4 | D. | 6:3:2 |
12.下列有关化学用语正确的是( )
| A. | 氮气分子的结构式N≡N | B. | 钾离子的电子式:K | ||
| C. | 硫原子的结构示意图 | D. | 二氧化硅的分子式:SiO2 |
9.铅蓄电池工作一段时间后,需要充电,则铅蓄电池的负极在充电时( )
| A. | 做电解池的阴极,和外加电源的负极相连 | |
| B. | 做电解池的阴极,和外加电源的正极相连 | |
| C. | 做电解池的阳极,和外加电源的负极相连 | |
| D. | 做电解池的阳极,和外加电源的正极相连 |