题目内容
5.一定量的钠、镁、铝分别与足量盐酸反应,放出的氢气的物质的量相等,则钠、镁、铝三种金属的物质的量之比为( )| A. | 1:1:1 | B. | 4:2:1 | C. | 2:3:4 | D. | 6:3:2 |
分析 盐酸足量,金属均完全反应,生成氢气的物质的量相等,则金属失去电子相等,以此来解答.
解答 解:盐酸足量,金属均完全反应,生成氢气的物质的量相等,则金属失去电子相等,
设钠、镁、铝三种金属的物质的量分别为x、y、z,
由电子守恒可知,
x×(1-0)=y×(2-0)=z×(3-0),
解得x:y:z=6:3:2,
故选D.
点评 本题考查氧化还原反应的计算,为高频考点,把握金属与盐酸的反应、电子守恒为解答的关键,侧重分析与计算能力的考查,注意过量判断,题目难度不大.

练习册系列答案
相关题目
15.下列实验操作或记录正确的是( )
| A. | 用两只250 mL的容量瓶配制0.1 mol/L 500 mL的NaOH溶液 | |
| B. | 用量筒测得排水法收集制得的氢气体积为50.28 mL | |
| C. | 常温常压下测得1 mol N2的质量为28 g | |
| D. | 用托盘天平称得2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g |
20.将Na、Mg、Al三种金属各0.3mol分别投入100ml 0.5mol/L稀硫酸中充分反应,则在标准状况下生成的氢气的体积比是( )
| A. | 1:1:1 | B. | 1:2:3 | C. | 3:1:1 | D. | 6:3:2 |
10.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如图所示变化规律(p表示压强,T表示温度,n表示物质的量):根据以上规律判断,下列结论正确的是( )


| A. | 反应Ⅰ:△H>0,p2>p1 | B. | 反应Ⅳ:△H<0,T2>T1 | ||
| C. | 反应Ⅲ:可能是△H>0,T2>T1 | D. | 反应Ⅱ:△H<0,T1<T2 |
9.下列实验事故的处理方法正确的是( )
| A. | 实验桌上的酒精灯倾倒了燃烧起来,马上用湿布扑灭 | |
| B. | 不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦 | |
| C. | 晚上在家闻到一股浓重的煤气味,赶紧开灯检查一下 | |
| D. | 浓硫酸溅到皮肤上,立即用稀氢氧化钠溶液洗涤 |
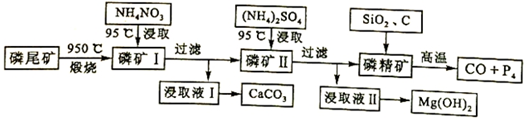
 氧化还原反应在生产、生活中具有广泛的用途,贯穿古今.
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今.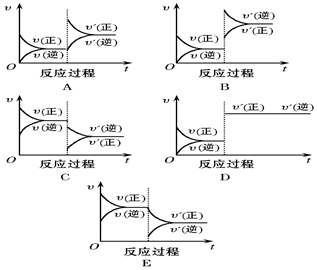 在一定条件下,反应A(g)+2B(s)?C(g)(正反应为吸热反应)达到平衡后,根据下列图象判断:
在一定条件下,反应A(g)+2B(s)?C(g)(正反应为吸热反应)达到平衡后,根据下列图象判断: