题目内容
【题目】结合图判断,下列叙述正确的是
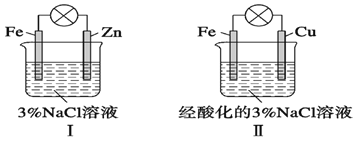
A. Ⅰ和Ⅱ中正极均被保护
B. Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+
C. Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH-
D. Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀
【答案】A
【解析】试题分析:A、I中锌比铁活泼,锌作负极,铁作正极,对铁保护,II中铁比铜活泼,铜作正极,对铜保护,故错误;B、I中铁作正极,锌作负极,Zn-2e-=Zn2+,II中铁作负极,Fe-2e-=Fe2+,故错误;C、I中正极电极反应式为:O2+2H2O+4e-=4OH-,II中酸化的溶液,正极电解反应式:O2+4H++4e-=2H2O,故错误;D、K3[Fe(CN)6]检验Fe2+,前者无沉淀,后者有蓝色沉淀,故错误。

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
【题目】下列装置或操作能达到目的的是

A. 装置①探究H2SO4浓度对反应速率的影响 B. 装置②可用于测定中和热
C. 装置③探究Mg(OH)2能否转化成Fe(OH)3 D. 装置④不能保护铁闸门被腐蚀
【题目】在温度相同、容积均为2L的三个恒容密闭容器中,按不同方式投入反应物,发生反应:N2(g)+3H2(g) ![]() 2NH3(g)△H= -92.4kJ/mol;保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是( )
2NH3(g)△H= -92.4kJ/mol;保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是( )
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1molN2、3molH2 | 2molN2、6molH2 | 2molNH3 |
NH3 的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
体系压强 | p1 | p2 | p3 |
反应物转化率 |
|
|
|
A. 2p1=2p3<p2 B. 达到平衡时丙容器中NH3的体积分数最大
C. Q3+92.4![]() =92.4 D.
=92.4 D. ![]() <1
<1