题目内容
【题目】归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)其归纳正确的是( )
①反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2∶1。
③pH相等的三种溶液:a.CH3COONa b.NaHCO3 c.NaOH,其溶质物质的量浓度由小到大顺序为:c、b、a
④常温下,pH=1的强酸溶液,加水稀释后,溶液中所有离子浓度均降低。
⑤在等物质的量浓度、等体积的氯化铵和氨水的混合溶液中存在下列关系:c(NH4+)+2c(H+)=2c(OH-)+c(NH3·H2O)
⑥反应A(g)![]() 2B(g)△H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则 △H =(Ea -Eb)kJ·mol-1。
2B(g)△H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则 △H =(Ea -Eb)kJ·mol-1。
A. 全部 B. ②④⑤⑥ C. ①③④⑥ D. ①③⑤⑥
【答案】D
【解析】①. 反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,说明△H-T△S>0,由于△S>0,所以△H一定大于0,即该反应为吸热反应,故①正确;②. pH=2的盐酸和pH=l的盐酸,c(H+)之比为:0.01mol/L:0.1mol/L=1:10,故②错误;③. 酸根离子对应酸的酸性越弱,相同浓度时水解程度越大,所以pH相等的三种溶液:a.CH3COONa b.NaHCO3 c.NaOH,其溶质物质的量浓度由小到大顺序为:c、b、a,故③正确;④. 常温下,pH=1的强酸溶液,加水稀释后,溶液中氢离子浓度减小,因水的离子积常数不变,所以氢氧根离子浓度一定增大,故④错误;⑤. 在等物质的量浓度、等体积的氯化铵和氨水的混合溶液中存在电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-)和物料守恒c(NH3H2O)+c(NH4+)=2c(Cl-),将两式合并得c(NH4+)+2c(H+)=2c(OH-)+c(NH3·H2O),故⑤正确;⑥. 因逆反应的活化能=正反应的活化能+反应的焓变,所以△H=逆反应的活化能-正反应的活化能=(Ea-Eb)kJ/mol,故⑥正确;答案选D。

【题目】下表各组物质之间通过一步反应不可以实现如图所示转化关系的是
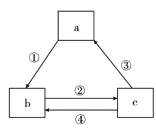
选项 | a | b | c | 箭头上所标数字的反应条件 |
A | AlCl3 | NaAlO2 | Al(OH)3 | ①加入过量的NaOH |
B | Na | Na2O | Na2O2 | ②常温加水 |
C | NaOH | NaHCO3 | Na2CO3 | ③加澄清石灰水 |
D | C | CO | CO2 | ④条件为高温 |
A. AB. BC. CD. D