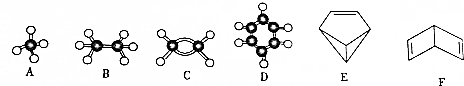
题目内容
20.充分燃烧2.8g某有机物A,生成8.8g CO2和3.6g H2O,这种有机物蒸气的相对密度是相同条件下N2的2倍.(1)该有机物的摩尔质量为56g/mol,分子式为C4H8;.
(2)该有机物链状同分异构体的结构简式为:CH2=CHCH2CH3、CH3CH=CH2CH3、
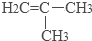 ;.
;.(3)若有机物A在核磁共振氢谱中只有一个信号峰(即只有一种氢原子),则A的结构简式为
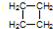 .
.
分析 有机物A蒸气的质量是同温同压下同体积N2的2倍,则该有机物的相对分子质量为2×28=56,则n(A)=$\frac{2.8g}{56g/mol}$=0.05mol,由原子守恒可知,n(C)=n(CO2)=$\frac{8.8g}{44g/mol}$=0.2mol,n(H)=2n(H2O)=2×$\frac{3.6g}{18g/mol}$=0.4mol,故有机物分子中含有C原子数目为$\frac{0.2mol}{0.05mol}$=4,含有H原子数目为$\frac{0.4mol}{0.05mol}$=8,O原子数目为$\frac{56-12×4-8}{16}$=0,所以A的分子式为C4H8.
解答 解:(1)有机物A蒸气的质量是同温同压下同体积N2的2倍,则该有机物的相对分子质量为2×28=56,摩尔质量为56g/mol,
n(A)=$\frac{2.8g}{56g/mol}$=0.05mol,由原子守恒可知,n(C)=n(CO2)=$\frac{8.8g}{44g/mol}$=0.2mol,n(H)=2n(H2O)=2×$\frac{3.6g}{18g/mol}$=0.4mol,故有机物分子中含有C原子数目为$\frac{0.2mol}{0.05mol}$=4,含有H原子数目为$\frac{0.4mol}{0.05mol}$=8,O原子数目为$\frac{56-12×4-8}{16}$=0,所以A的分子式为C4H8;
故答案为:56g/mol;C4H8;
(2)该有机物链状同分异构体的结构简式为:CH2=CHCH2CH3、CH3CH=CH2CH3、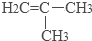 ,
,
故答案为:CH2=CHCH2CH3、CH3CH=CH2CH3、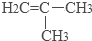 ;
;
(3)若有机物A在核磁共振氢谱中只有一个信号峰(即只有一种氢原子),则不可能为烯烃,应为环丁烷,结构简式为: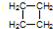 ,
,
故答案为: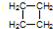 .
.
点评 本题考查了有机物分子式与结构式的确定、同分异构体书写等,掌握燃烧法利用原子守恒确定有机物分子式,试题培养了学生的分析计算能力.

| A. | 铁与稀盐酸反应:Fe+2H+=Fe2++H2↑ | |
| B. | 氨水与盐酸反应:OH-+H+=H2O | |
| C. | 锌与硫酸铜溶液反应:Zn+Cu2+=Zn2++Cu | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O |
| A. | 乙烯的结构简式为:CH2CH2 | B. | 苯的分子式为:C6H6 | ||
| C. | 四氯化碳的电子式为 | D. | 丙烷分子的比例模型  |
| A. | 0.067mol | B. | 0.02mol | C. | 0.03mol | D. | 0.04mol |
 和
和 .
. .
.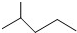 表示的分子式是C6H14;名称是2-甲基戊烷.
表示的分子式是C6H14;名称是2-甲基戊烷.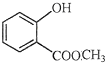 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.