题目内容
10.SO2的催化氧化是工业制取硫酸的关键步骤之一,该反应在容积固定的合成塔内进行:2SO2+O2$?_{△}^{催化剂}$2SO3,△H<0.请回答下列问题:
(1)判断该反应达到平衡状态的标志是bc(填字母).
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
(2)当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的是bd.(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.降低温度
(3)将0.050mol SO2 (g)和0.030mol O2(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测得c(SO3)=0.040mol•L-1.计算该条件下反应的平衡常数K和SO2的转化率(不必写出计算过程).
①平衡常数K=1.6×103;
②平衡时,SO2的转化率α(SO2)=80%.
分析 (1)反应达到平衡状态的标志是正逆反应速率相同个组分含量保持不变,据此分析选项;
(2)当该反应处于平衡状态时,在体积不变的条件下,提高SO2平衡转化率,平衡正向进行;
(3)依据化学平衡三段式列式计算;
①平衡常数用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到;
②转化率=$\frac{消耗量}{起始量}$×100%.
解答 解:(1)a.SO2和SO3浓度相等,不能怎么正逆反应速率相同,不能说明反应达到平衡状态,故a错误;
b.SO2百分含量保持不变是平衡标志,故b正确;
c.反应前后气体体积分数变化,容器中气体的压强不变说明反应达到平衡状态,故C正确;
d.SO3的生成速率与SO2的消耗速率相等是你反应正向进行,不能说明反应达到平衡状态,故d错误;
故答案为:bc;
(2)当该反应处于平衡状态时,在体积不变的条件下,提高SO2平衡转化率,平衡正向进行;
a.向装置中再充入N2,恒容恒温容器中总压增大分压不变,平衡不变,故a错误;
b.两种反应物增加一种会提高另一种的转化率,向装置中再充入O2,会提高二氧化硫转化率,故b正确;
c.改变反应的催化剂,改变反应速率不改变化学平衡,故c错误;
d.反应是放热反应,降低温度平衡正向进行,二氧化硫转化率增大,故d正确;
故答案为:bd;
(3)将0.050mol SO2(g)和0.030mol O2(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测得c(SO3)=0.040mol/L.
2SO2 +O2 ?2SO3,
起始量(mol) 0.05 0.03 0
变化量(mol) 0.04 0.02 0.04
平衡量(mol) 0.01 0.01 0.04
①平衡常数K=$\frac{0.0{4}^{2}}{0.0{1}^{2}×0.01}$=1.6×103,故答案为:1.6×103;
②平衡时,SO2的转化率α(SO2)=$\frac{0.04mol}{0.05mol}$×100%=80%,故答案为:80%.
点评 本题考查了化学平衡状态的分析判断,平衡移动原理理解应用,化学平衡常数、转化率计算,掌握基础是关键,题目难度中等.

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案| A. | 硫酸钠的电离方程式:Na2SO4=Na2++SO42- | |
| B. | Mg2+的结构示意图: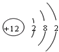 | |
| C. | 氮气的结构式::N≡N: | |
| D. | 氯化镁的电子式: |
| A. | 在原电池的负极和电解池的阴极上都发生失电子的氧化反应 | |
| B. | 电解是把电能转化成化学能 | |
| C. | 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH | |
| D. | 钢铁发生电化学腐蚀时生成Fe3O4 |
| A. | υ(A)=1.5 mol•L-1•s-1 | B. | υ(B)=0.5 mol•L-1•s-1 | ||
| C. | υ(C)=0.8 mol•L-1•s-1 | D. | υ(D)=1 mol•L-1•s-1 |
 .
. .
. .
. ;.
;. .
.