题目内容
镍(28Ni)金属羰基化合物[金属元素和一氧化碳(CO)中性分子形成的一类配合物]、金属储氢材料[能可逆的多次吸收、储存和释放氢气(H2)的合金]等领域用途广泛。
(1)Ni原子基态核外电子排布式为_________________。
(2)Ni(CO)4中镍的化合价为_____________,写出与CO互为等电子体的中性分子、带一个单位正电荷的阳离子、带一个单位负电荷的阴离子各一个:__________、_____________、___________。
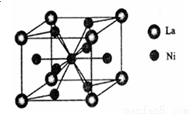
(3)一种储氢合金由镍与镧(La)组成,其晶胞结构如图所示.则该晶体的化学式为_________。
(4)下列反应常用来检验Ni2+,请写出另一产物的化学式__________。
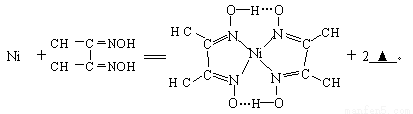
与Ni2+配位的N原子有_________个,该配合物中存在的化学键有__________(填序号)。
A共价键 B离子键 C配位键 D金属键 E氢键
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
a、铵盐中氮元素的化合价为-3价
b、铵盐都能水,铵盐中只含有非金属元素而不可能含有金属元素
c、铵盐都不稳定,受热分解都产生氨气
d、铵盐都是离子化合物,都能与强碱反应
e、用浓氯化铵溶液处理过的舞台幕布不易着火的原因是氯化铵分解吸收热量,降低了温度;分解产生的气体隔开了空气.
| A. | bcde | B. | abde | C. | abc | D. | ace |
| A.装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 | B.装置可除去CO2中含有的少量HCl | C.装置可制备氨气 | D.装置可制取、收集并吸收多余的HCl |
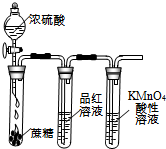 |  | 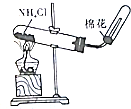 | 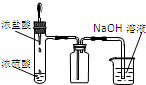 |
| A. | A | B. | B | C. | C | D. | D |
以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
2 mL | 0.2 mol·L?1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
0.2 mol·L?1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
0.1 mol·L?1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:____________。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42?,含有Cu+、Cu2+和SO32?。
已知:Cu+ Cu +Cu2+,Cu2+
Cu +Cu2+,Cu2+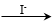 CuI↓(白色)+I2。
CuI↓(白色)+I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是_____________。
②通过下列实验证实,沉淀中含有Cu2+和SO32?。
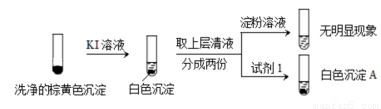
a.白色沉淀A是BaSO4,试剂1是____________。
b.证实沉淀中含有Cu+和SO32?的理由是_______________。
(3)已知:Al2(SO3)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42?,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和____________。
②对于沉淀中亚硫酸根的存在形式提出两种假设:i. Al(OH)3所吸附;ii.存在于铝的碱式盐中。对假设ii设计了对比实验,证实了假设ii成立。
将对比实验方案补充完整。
步骤一:
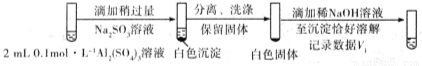
步骤二:

则V1___________V2(填>,<或=)。
(4)根据实验,亚硫酸盐的性质有___________。盐溶液间反应的多样性与__________有关。
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液.称量时,样品可放在A(填编号字母)称量.
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.20mol•L-的盐酸来滴定待测液,不可选用B(填编号字母)作指示剂.
A.甲基橙 B.石蕊 C.酚酞
(3)根据下表数据,计算被测烧碱溶液的物质的量浓度是0.4000mol/L,烧碱样品的纯度是97.56%
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
(5)下列实验操作会对滴定结果产生什么后果?(填“偏高”、“偏低”或“无影响”)
①若将锥形瓶用待测液润洗,然后加入10.00mL待测液,则滴定结果偏高
②若锥形瓶未干燥就加入10.00mL待测液,则滴定结果无影响.


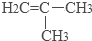 ;.
;.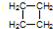 .
.