题目内容
(1)一定温度下,在恒容密闭容器中NO2与O2反应为4NO2(g)+O2(g)?2N2O5(g).(不考虑NO2的分解 ) 若已知该反应是放热反应,则K550℃ K350℃,(填“大于”“等于”或“小于”).反应达平衡后,若再通入一定量NO2,则平衡常数K将 ,NO2的转化率 .(填“增大”“减小”或“不变”)
(2)若初始时在恒容密闭容器中加入N2O5,下表为N2O5分解反应在一定温度下不同时间测得N2O5浓度的部分实验数据:
①写出该反应的平衡常数表达式:K= .
②1000s内N2O5的分解速率为: .
③若每有1mol N2O5分解,吸收Q kJ的热量,写出该分解反应的热化学方程式 .
④能使4NO2(g)+O2(g)?2N2O5(g)反应速率增大,且平衡向正反应方向移动的是
a.及时分离出N2O5b.适当提高温度 c.增大O2浓度 d.选择高效催化剂.
(2)若初始时在恒容密闭容器中加入N2O5,下表为N2O5分解反应在一定温度下不同时间测得N2O5浓度的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5) mol/L | 5.00 | 3.25 | 2.48 |
②1000s内N2O5的分解速率为:
③若每有1mol N2O5分解,吸收Q kJ的热量,写出该分解反应的热化学方程式
④能使4NO2(g)+O2(g)?2N2O5(g)反应速率增大,且平衡向正反应方向移动的是
a.及时分离出N2O5b.适当提高温度 c.增大O2浓度 d.选择高效催化剂.
考点:化学平衡的计算,化学平衡常数的含义,化学平衡的影响因素
专题:化学平衡专题
分析:(1)反应是放热反应,温度升高,平衡逆向进行,平衡常数减小;若再通入一定量NO2,二氧化氮转化率减小,平衡常数随温度变化,温度不变平衡常数不变;
(2)①依据化学方程式书写平衡常数,用生成物浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积;
②依据反应速率概念计算应用;
③每有1mol N2O5分解,吸收Q kJ的热量,分解2molN2O5分解,吸收2Q kJ的热量,标注物质聚集状态和对应反应的焓变写出热化学方程式;
④依据化学平衡移动原理和反应特征分析选项.
(2)①依据化学方程式书写平衡常数,用生成物浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积;
②依据反应速率概念计算应用;
③每有1mol N2O5分解,吸收Q kJ的热量,分解2molN2O5分解,吸收2Q kJ的热量,标注物质聚集状态和对应反应的焓变写出热化学方程式;
④依据化学平衡移动原理和反应特征分析选项.
解答:
解:(1)一定温度下,在恒容密闭容器中NO2与O2反应为4NO2(g)+O2(g)?2N2O5(g).(不考虑NO2的分解 ) 若已知该反应是放热反应,温度升高,平衡逆向进行,平衡常数减小,K550℃ 小于K350℃;若再通入一定量NO2,提高氧气的转化率,二氧化氮转化率减小,平衡常数随温度变化,温度不变平衡常数不变,
故答案为:小于;不变;减小;
(2)①应为4NO2(g)+O2(g)?2N2O5(g),反应的平衡常数表达式K=
,故答案为:
;
②1000s内N2O5的消耗物质的量浓度=5.00mol/L-2.48mol/L=2.53mol/L,分解速率=
=0.00252mol/L?s,故答案为:0.00252mol/L?s;
③每有1mol N2O5分解,吸收Q kJ的热量,分解2molN2O5分解,吸收2Q kJ的热量,标注物质聚集状态和对应反应的焓变写出热化学方程式:2N2O5(g)=4NO2(g)+O2(g)△H=+2QkJ/mol,
故答案为:2N2O5(g)=4NO2(g)+O2(g)△H=+2QkJ/mol;
④能使4NO2(g)+O2(g)?2N2O5(g)反应速率增大,且平衡向正反应方向移动;
a.及时分离出N2O5,反应速率减小,平衡正向进行,故a错误;
b.适当提高温度,反应速率增大,反应是放热反应,升温平衡逆向进行,故b错误
c.增大O2浓度,反应速率增大,平衡正向进行,故c正确;
d.选择高效催化剂,增大反应速率,但不改变化学平衡,故d错误;
故选c.
故答案为:小于;不变;减小;
(2)①应为4NO2(g)+O2(g)?2N2O5(g),反应的平衡常数表达式K=
| c2(N2O5) |
| c4(NO2)c(O2) |
| c2(N2O5) |
| c4(NO2)c(O2) |
②1000s内N2O5的消耗物质的量浓度=5.00mol/L-2.48mol/L=2.53mol/L,分解速率=
| 2.53mol/L |
| 1000s |
③每有1mol N2O5分解,吸收Q kJ的热量,分解2molN2O5分解,吸收2Q kJ的热量,标注物质聚集状态和对应反应的焓变写出热化学方程式:2N2O5(g)=4NO2(g)+O2(g)△H=+2QkJ/mol,
故答案为:2N2O5(g)=4NO2(g)+O2(g)△H=+2QkJ/mol;
④能使4NO2(g)+O2(g)?2N2O5(g)反应速率增大,且平衡向正反应方向移动;
a.及时分离出N2O5,反应速率减小,平衡正向进行,故a错误;
b.适当提高温度,反应速率增大,反应是放热反应,升温平衡逆向进行,故b错误
c.增大O2浓度,反应速率增大,平衡正向进行,故c正确;
d.选择高效催化剂,增大反应速率,但不改变化学平衡,故d错误;
故选c.
点评:本题考查了化学平衡影响因素,平衡常数计算应用,热化学方程式书写方法,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
当两极都用银片作电极电解硝酸银水溶液时,在阳极的产物是( )
| A、只有银 | B、只有氢气 |
| C、银和氢气 | D、上述都不对 |
在一定温度下,向某固定容积的密闭容器中加入1mol N2和3mol H2,发生如下反应:N2(g)+3H2(g)?2NH3(g).此反应达到平衡的标志是( )
| A、容器内气体密度不再发生变化 |
| B、容器内各物质的浓度不再发生变化 |
| C、正反应和逆反应都已停止 |
| D、单位时间消耗0.1mol N2的同时生成0.2mol NH3 |
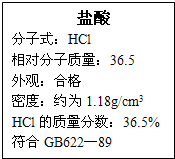 右图为某市售盐酸试剂瓶标签上的部分数据,通过计算回答:
右图为某市售盐酸试剂瓶标签上的部分数据,通过计算回答: )有关的化学方程式:
)有关的化学方程式: