题目内容
关于下列各图的叙述正确的是( )
A、 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ?mol-1 |
B、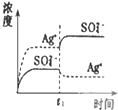 表示向Ag2SO4饱和溶液中加入等体积Na2SO4稀溶液,平衡会向左移动,Ksp减小 |
C、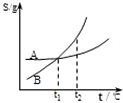 表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A |
D、 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液 |
考点:反应热和焓变,溶液中溶质的质量分数及相关计算,难溶电解质的溶解平衡及沉淀转化的本质
专题:图示题
分析:A、依据燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,水为液态;
B、溶度积只与温度有关,与离子浓度无关;
C、首先比较t1℃时二者的溶质质量分数关系,再判断升温后溶液中有晶体析出还是变为不饱和溶液,若有晶体析出,则溶质质量分数会变小,若变为不饱和溶液,则溶质质量分数将不变;
D、pH相同的两种酸,稀释相同的倍数,pH变化大的酸的酸性强,变化小的酸的酸性弱,则HA是强酸,HB是弱酸,酸越弱,对应的酸根离子水解程度越大,碱性越强,pH越大;
B、溶度积只与温度有关,与离子浓度无关;
C、首先比较t1℃时二者的溶质质量分数关系,再判断升温后溶液中有晶体析出还是变为不饱和溶液,若有晶体析出,则溶质质量分数会变小,若变为不饱和溶液,则溶质质量分数将不变;
D、pH相同的两种酸,稀释相同的倍数,pH变化大的酸的酸性强,变化小的酸的酸性弱,则HA是强酸,HB是弱酸,酸越弱,对应的酸根离子水解程度越大,碱性越强,pH越大;
解答:
解:A、图象表示2H2(g)+O2(g)═2H2O(g)△H1=-483.6kJ?mol-1,因水是气态,无法求出氢气燃烧热,故A错误;
B、向Ag2SO4饱和溶液中加入等体积Na2SO4稀溶液,平衡会向左移动,硫酸根离子浓度增大,银离子浓度减小,Ksp不变,故B错误;
C、在t1℃时,A、B的饱和溶液中,溶质质量分数=
×100%,而二者此温度溶解度相等,故它们的溶质质量分数也相等.升温时,两种物质的溶解度都随温度的升高而变大,溶液均变为不饱和溶液,都没有晶体析出,即溶质质量分数均不变,故C错误;
D、pH相同的两种酸,稀释相同的倍数,pH变化大的酸的酸性强,变化小的酸的酸性弱,则HA是强酸,HB是弱酸,酸越弱,对应的酸根离子水解程度越大,碱性越强,pH越大,所以则同浓度的NaA溶液的pH小于NaB溶液,故D正确;
故选D.
B、向Ag2SO4饱和溶液中加入等体积Na2SO4稀溶液,平衡会向左移动,硫酸根离子浓度增大,银离子浓度减小,Ksp不变,故B错误;
C、在t1℃时,A、B的饱和溶液中,溶质质量分数=
| 溶解度 |
| 100g+溶解度 |
D、pH相同的两种酸,稀释相同的倍数,pH变化大的酸的酸性强,变化小的酸的酸性弱,则HA是强酸,HB是弱酸,酸越弱,对应的酸根离子水解程度越大,碱性越强,pH越大,所以则同浓度的NaA溶液的pH小于NaB溶液,故D正确;
故选D.
点评:本题以图象的形式考查了燃烧热、沉淀溶解平衡、溶解度曲线、弱电解质的电离等知识,难度不大,注意相关知识点的掌握.

练习册系列答案
相关题目
| 1 |
| 28 |
A、
| ||
| B、14x mol-1 | ||
| C、28x mol-1 | ||
| D、28x |
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水反应的离子方程式为:
4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾.制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备:2Fe(OH)3+3ClO-+4OH-═3FeO42-+3Cl-+5H2O 干法制备:2FeSO4+6Na2O2═2Na2FeO4+2Na2SO4+O2↑
下列有关说法错误的是( )
4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾.制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备:2Fe(OH)3+3ClO-+4OH-═3FeO42-+3Cl-+5H2O 干法制备:2FeSO4+6Na2O2═2Na2FeO4+2Na2SO4+O2↑
下列有关说法错误的是( )
| A、高铁酸钾与水反应时,水发生氧化反应 |
| B、干法制备中,每生成1mol Na2FeO4,共转移4mol电子 |
| C、湿法制备中,每生成1mol Na2FeO4,共转移3mol电子 |
| D、K2FeO4处理水时,不仅能杀菌,还能除去等H2S、NH3,并使悬浮杂质沉降 |
某溶液中含有下列六种离子:①HCO3-②SO32-③Na+④CO32-⑤NH4+⑥NO3-⑦SO42-向其中加入一定量Na2O2后,溶液中离子浓度基本保持不变的是( )
| A、①②⑤⑥ | B、③④⑤⑦ |
| C、②④⑦⑥ | D、只有⑥ |
下列各组中的离子因发生氧化还原反应而不能大量共存的是( )
| A、H+、Na+、CO32-、Cl- |
| B、Ca2+、K+、S2-、ClO- |
| C、Fe2+、CO32-、Cl-、NO3- |
| D、HCO3-、Br-、OH-、SO42- |
下列各组物质中,所含分子数不相同的是( )
| A、2.24L H2(标准状况)和0.1mol N2 |
| B、5.6L N2(标准状况)和11g CO2 |
| C、10g H2和10g O2 |
| D、9g H2O和0.5mol Br2 |
下列灭火剂能用于扑灭金属钠着火的是( )
| A、干冰灭火剂 |
| B、黄砂 |
| C、干粉(含NaHCO3)灭火剂 |
| D、泡沫灭火剂 |
