题目内容
下列说法正确的有几个( )
①反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H>0
②电解法精炼铜时,以粗铜作阴极,纯铜作阳极
③向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO2-完全沉淀:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3?H2O+2BaSO4↓
④测定NaCl和NaF溶液的pH值,确定F、Cl两元素非金属性的强弱
⑤Na2SiO3溶液加热、蒸干、灼烧后所得固体的成分是SiO2
⑥配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
⑦AgCl沉淀可以转化为AgI沉淀
⑧为绘制中和滴定曲线,在滴定过程中,每隔相同时间用pH计测定一次锥形瓶中溶液的pH.
①反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H>0
②电解法精炼铜时,以粗铜作阴极,纯铜作阳极
③向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO2-完全沉淀:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3?H2O+2BaSO4↓
④测定NaCl和NaF溶液的pH值,确定F、Cl两元素非金属性的强弱
⑤Na2SiO3溶液加热、蒸干、灼烧后所得固体的成分是SiO2
⑥配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
⑦AgCl沉淀可以转化为AgI沉淀
⑧为绘制中和滴定曲线,在滴定过程中,每隔相同时间用pH计测定一次锥形瓶中溶液的pH.
| A、0 | B、1 | C、2 | D、3 |
考点:反应热和焓变,非金属在元素周期表中的位置及其性质递变的规律,盐类水解的应用,难溶电解质的溶解平衡及沉淀转化的本质,电解原理,酸碱混合时的定性判断及有关ph的计算
专题:基本概念与基本理论
分析:①当△G=△H-T?△S<0时,反应能自发进行;
②用电解法精炼精铜时,粗铜作阳极,纯铜作阴极;
③向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,说明SO42-与Ba2+的比例是1:2;
④元素非金属性越强,最高价氧化物对应的水化物酸性越强;
⑤Na2SiO3水解生成硅酸和氢氧化钠,硅酸不挥发,又能与氢氧化钠生成硅酸钠;
⑥铁离子水解,故应加入相应的酸防止水解;
⑦根据溶解度大的沉淀可以转化成溶解度小的沉淀;
⑧中和滴定曲线是溶液pH值与加入滴定液的体积关系;绘制中和滴定曲线,在滴定过程中,每隔一定滴定液体积用量(不是时间),观察一次锥形瓶中溶液的PH.
②用电解法精炼精铜时,粗铜作阳极,纯铜作阴极;
③向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,说明SO42-与Ba2+的比例是1:2;
④元素非金属性越强,最高价氧化物对应的水化物酸性越强;
⑤Na2SiO3水解生成硅酸和氢氧化钠,硅酸不挥发,又能与氢氧化钠生成硅酸钠;
⑥铁离子水解,故应加入相应的酸防止水解;
⑦根据溶解度大的沉淀可以转化成溶解度小的沉淀;
⑧中和滴定曲线是溶液pH值与加入滴定液的体积关系;绘制中和滴定曲线,在滴定过程中,每隔一定滴定液体积用量(不是时间),观察一次锥形瓶中溶液的PH.
解答:
解:①反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,△G=△H-T?△S<0,?△S<0,则该反应的△H<0,故错误;
②电解法精炼铜时,以粗铜作阳极,纯铜作阴极,故错误;
③向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,离子方程式为:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3?H2O+2BaSO4↓,故正确;
④测定NaCl和NaF溶液的pH值,只能确定HCl和HF酸性强弱,无法确定F、Cl两元素非金属性的强弱,故错误;
⑤Na2SiO3水解生成硅酸和氢氧化钠,硅酸不挥发,又能与氢氧化钠生成硅酸钠,所以Na2SiO3溶液加热、蒸干、灼烧后所得固体的成分是Na2SiO3,故错误;
⑥配制FeCl3溶液时,将FeCl3固体溶解在盐酸中,然后再用水稀释到所需的浓度,故错误;
⑦溶解度:AgCl>AgI,所以AgCl沉淀可以转化为AgI沉淀,故正确;
⑧中和滴定曲线是溶液pH值与加入滴定液的体积关系,不是与时间故选,绘制中和滴定曲线,在滴定过程中,每隔一定滴定液体积用量观察一次锥形瓶中溶液的PH,故错误;
故选C.
②电解法精炼铜时,以粗铜作阳极,纯铜作阴极,故错误;
③向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,离子方程式为:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3?H2O+2BaSO4↓,故正确;
④测定NaCl和NaF溶液的pH值,只能确定HCl和HF酸性强弱,无法确定F、Cl两元素非金属性的强弱,故错误;
⑤Na2SiO3水解生成硅酸和氢氧化钠,硅酸不挥发,又能与氢氧化钠生成硅酸钠,所以Na2SiO3溶液加热、蒸干、灼烧后所得固体的成分是Na2SiO3,故错误;
⑥配制FeCl3溶液时,将FeCl3固体溶解在盐酸中,然后再用水稀释到所需的浓度,故错误;
⑦溶解度:AgCl>AgI,所以AgCl沉淀可以转化为AgI沉淀,故正确;
⑧中和滴定曲线是溶液pH值与加入滴定液的体积关系,不是与时间故选,绘制中和滴定曲线,在滴定过程中,每隔一定滴定液体积用量观察一次锥形瓶中溶液的PH,故错误;
故选C.
点评:本题是道综合性题目,涉及盐类水解、沉淀转化、中和滴定、沉淀的转化等,难度中等,注意铁盐、亚铁盐溶液的配制.

练习册系列答案
相关题目
关于下列各图的叙述正确的是( )
A、 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ?mol-1 |
B、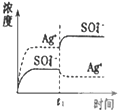 表示向Ag2SO4饱和溶液中加入等体积Na2SO4稀溶液,平衡会向左移动,Ksp减小 |
C、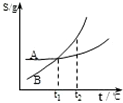 表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A |
D、 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液 |
下列说法中正确的是( )
| A、除去乙烷中混有的乙烯的方法是通氢气在一定条件下反应,使乙烯转化为乙烷 |
| B、苯、溴苯在常温、常压下为无色且密度比水小的液体 |
| C、丙烯与2-丁烯都存在順反异构体 |
| D、苯不能与溴水发生加成反应,也不能被酸性KMnO4溶液氧化 |
已知两种弱酸HA、HB的电离平衡常数Ka(HA)>Ka(HB).下列有关说法正确的是( )
| A、等温浓度均为0.1mol?L-1的HA、HB溶液中,其溶液的pH大小为:pH(HA)>pH(HB) |
| B、在0.1mol?L-1的NaA溶液中各离子浓度关系为:c(Na+)>c(A-)>c(OH-)>c(H+) |
| C、等体积pH相同的HA、HB溶液,分别加入等浓度的NaOH溶液,恰好完全反应消耗的NaOH溶液体积HA比HB多 |
| D、等温浓度均为0.1mol?L-1的NaA、NaB溶液中,其溶液的pH大小为:pH(NaA)>pH(NaB) |
在离子浓度都为0.1mol/L的下列溶液中,加入(或通入)某物质后,发生反应先后顺序正确的是( )
| A、在含Fe3+、Cu2+、H+的溶液中加入锌粉:Cu2+、Fe3+、H+ |
| B、在含I-、SO32-、Br-的溶液中不断通入氯气:I-、Br-、SO32- |
| C、在含AlO2-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO2-、SO32- |
| D、在含Fe3+、H+、NH4+的溶液中逐渐加入烧碱溶液:H+、NH4+、Fe3+ |
分类是学习化学的重要方法,下列归纳正确的是( )
| A、纯碱、烧碱都属于碱类 |
| B、冰和干冰既是纯净物又是化合物 |
| C、铅笔芯、铅球主要成分都是铅 |
| D、液氯和氯水是同一种物质 |
下列说法不正确的是( )
| A、胶体能发生电泳现象是因为胶体带电 |
| B、生石灰与水混合的过程只发生物理变化 |
| C、O3是由3个氧原子构成的化合物 |
| D、CuSO4?5H2O是一种混合物 |
下列选项的说法中正确的是( )
| A、分子的结构是由键角决定的 |
| B、共价键的键能越大,共价键越牢固 |
| C、CF4、CCl4、CBr4、CI4中C-X键的键长、键角均相等 |
| D、H2O分子中的两个O-H键的键角为180° |
