题目内容
7.下列说法正确的是( )| A. | N2、O2和Cl2分子中既含有σ键,又含有π键 | |
| B. | PCl3分子中,中心原子采取sp3杂化方式 | |
| C. | CS2、H2O、C2H2都是直线型分子 | |
| D. | CH4、C6H6都是只含有极性键的非极性分子 |
分析 A.单键中只有σ键,双键中含有σ键和π键;
B.分子中心原子的价层电子对数=孤电子对+σ键电子对,再判断杂化类型;
C.H2O为V形分子;
D.C6H6中含有碳碳非极性键.
解答 解:A.单键中只有σ键,双键中含有σ键和π键,Cl2分子中只含有σ键,N2、O2分子中既含有σ键,又含有π键,故A错误;
B.PCl3分子中P原子的价层电子对数=3+$\frac{1}{2}$(5-3×1)=4,中心原子采取sp3杂化方式,故B正确;
C.CS2、C2H2都是直线型分子,H2O为V形分子,故C错误;
D.CH4中只含有C-H极性键,C6H6中含有碳碳非极性键,故D错误.
故选B.
点评 本题考查了共价键的类型、杂化类型的判断、分子构型的判断,题目难度不大,侧重于基础知识的考查.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目
17.下列分子或离子与SO42-互为等电子体的是( )
| A. | PCl5 | B. | CCl4 | C. | NF3 | D. | NH4+ |
18.有关如图所示化合物的说法不正确的是( )
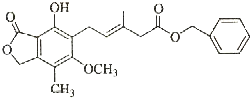

| A. | 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 | |
| B. | 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 | |
| C. | 可以催化加氢,1mol该物质最多可与7mol H2反应 | |
| D. | 该化合物有4种官能团,可以使酸性KMnO4溶液褪色 |
15.下列说法正确的是( )
| A. | 在25℃、1.01×105Pa的条件下,22.4L H2中含有的分子数为0.1NA | |
| B. | 1L 1mol•L-1的CaCl2溶液中含Cl-的数目为2NA | |
| C. | 40g NaOH溶解在1L水中,所制得的100mL溶液中含Na+数为0.1NA | |
| D. | 22g CO2与标准状况下11.2L H2O含有相同分子数 |
2.有如图所示的装置,当电流表中产生持续电流时,下列说法正确的是( )


| A. | Cu是原电池的负极 | |
| B. | Al是原电池的负极 | |
| C. | 电子由Al沿导线流向铜 | |
| D. | 铝片上的电极反应式为:Al-3e-═AL3+ |
19.下列事实中,可以证明NaCl中一定存在离子键的是( )
| A. | 有较高的熔点 | B. | 熔化时能导电 | C. | 水溶液能导电 | D. | 易溶于水 |
16.下列有关化学用语正确的是( )
| A. | Na+的基态电子排布图是: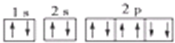 | |
| B. | 质量数之和是质子数之和两倍的水分子符号可能是:D${\;}_{2}^{1}$O | |
| C. | Na22的电子式: | |
| D. | 氯离子结构示意图为: |
 NH3•H2O
NH3•H2O NH4++OH-.
NH4++OH-.
