题目内容
8. 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )| A. | 苛性钾溶液中KOH的质量是16.8 | |
| B. | 反应中转移电子0.21mol | |
| C. | 氯气被还原成0.06molClO-和0.03molClO3- | |
| D. | ClO3-的生成是由于温度升高引起的 |
分析 A.根据电子转移守恒计算n(Cl-),根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-),结合m=nM计算KOH质量
B.氯气和氢氧化钾溶液反应生成次氯酸钾、氯化价和氯酸钾,根据图象知n(ClO-)=0.06mol,n(ClO3-)=0.03mol,由ClO-、ClO3-的物质的量,结合Cl元素化合价变化计算转移电子数目;
C.ClO-、ClO3-都是氧化产物;
C.根据图象知,氯气和氢氧化钾先生成次氯酸钾,且该反应是放热反应,随着温度的升高,氯气和氢氧化钾反应生成氯酸钾.
解答 解:A.根据电子转移守恒可知n(Cl-)=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.21mol+0.06mol+0.03mol=0.3mol,则n(KOH)=0.3mol,则氢氧化钾质量=0.3mol×56g/mol=16.8g,故A正确;
B.氯气和氢氧化钠溶液反应生成次氯酸钠、氯化钠和氯酸钠,根据图象知n(ClO-)=0.06mol,n(ClO3-)=0.03mol,故转移电子物质的量=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故B正确;
C.ClO-、ClO3-都是氧化产物,所以氯气被氧化成0.06molClO-和0.03molClO3-,故C错误;
D.根据图象知,氯气和氢氧化钾先生成次氯酸钾,且该反应是放热反应,随着温度的升高,氯气和氢氧化钾反应生成氯酸钾,所以氯酸根离子的生成是由于温度升高引起的,故D正确;
故选C.
点评 本题考查了氧化还原反应的计算,为高频考点,明确该反应中的生成物是解本题关键,结合原子守恒、转移电子守恒来分析解答,题目难度中等.

③2FeCl2+Cl2═2FeCl3,下列说法正确的是( )
| A. | 反应①中氧化剂与还原剂的物质的量之比为1:6 | |
| B. | 反应②中FeCl3只作氧化剂,反应③中FeCl3只是氧化产物 | |
| C. | 反应②中每生成127g I2,转移的电子数为2NA | |
| D. | 根据上述三个反应可知氧化性:ClO3->Cl2>Fe3+>I2 |
 室温下,将x mol•L-1NaOH溶液滴10mL 0.1mol•L-1的醋酸溶液中,溶液的温度和pH变化如图所示.下列说法正确的是( )
室温下,将x mol•L-1NaOH溶液滴10mL 0.1mol•L-1的醋酸溶液中,溶液的温度和pH变化如图所示.下列说法正确的是( )| A. | x=0.1 | |
| B. | 滴定过程中应该选择甲基橙作为指示剂 | |
| C. | c点对应的溶液中水的电离程度最大 | |
| D. | b点对应的溶液中c(H+)=(OH-)=C(Na+)=c(CH3COO-) |
| A. | 烧碱溶液与小苏打溶液反应:OH-+HCO3-═H2O+CO2↑ | |
| B. | 铝粉与烧碱溶液反应:2Al+2OH-+H2O═2AlO2-+2H2↑ | |
| C. | 氢氧化铝与氢溴酸 Al(OH)3+3HBr═Al3++3H2O | |
| D. | 过量CO2通入漂白粉溶液中 CO2+H2O+ClO-═HCO3-+HClO |
| 选项 | 物质用途 | 原理 |
| A | 高纯硅常作太阳能电池材料 | 硅是电的良导体 |
| B | 草木灰与铵态氮肥混合使用能提高肥效 | 铵盐与K2CO3在水中发生双水解,有利于NH3逸出 |
| C | 漂粉精能漂白有色衣物等 | 4Fe(NO3)3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+12NO2↑+3O2↑具有强氧化性,氧化色素 |
| D | 可燃冰是一种具有潜力的清洁能源 | CH4完全燃烧,不产生烟尘 |
| A. | A | B. | B | C. | C | D. | D |

| A. | a点对应的溶液中水的电离程度可能大于c点对应的溶液中水的电离程度 | |
| B. | 将25℃时的NaCl溶液加热到T℃,则该溶液中的c(OH-)由b点变化到e点 | |
| C. | bd线上的任意一点均有pH=7 | |
| D. | a点对应的溶液中大量存在的离子可能为:NH4+、Ba2+、NO3-、F- |
| A. | “地沟油”禁止食用,但经加工处理后可用来制造肥皂和生物柴油 | |
| B. | 白铁(镀锌铁板)比马口铁(镀锡铁板)更耐腐蚀 | |
| C. | 牺牲阳极的阴极保护法是应用电解原理防止金属的腐蚀 | |
| D. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应的△H=+2×283.0KJ/mol |

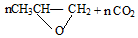 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$

