题目内容
13.下列离子方程式书写正确的是( )| A. | 烧碱溶液与小苏打溶液反应:OH-+HCO3-═H2O+CO2↑ | |
| B. | 铝粉与烧碱溶液反应:2Al+2OH-+H2O═2AlO2-+2H2↑ | |
| C. | 氢氧化铝与氢溴酸 Al(OH)3+3HBr═Al3++3H2O | |
| D. | 过量CO2通入漂白粉溶液中 CO2+H2O+ClO-═HCO3-+HClO |
分析 A.烧碱溶液与小苏打溶液反应生成碳酸钠和水;
B.铝粉与烧碱溶液反应生成偏铝酸钠和氢气,选项中不符合电子守恒、原子守恒;
C.氢溴酸为强酸完全电离;
D.过量CO2通入漂白粉溶液中生成次氯酸和碳酸氢钙.
解答 解:A.烧碱溶液与小苏打溶液反应生成碳酸钠和水:OH-+HCO3-═H2O+CO32-,故A错误;
B.铝粉与烧碱溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑,故B错误;
C,氢溴酸为强酸完全电离,氢氧化铝与氢溴酸 Al(OH)3+3H+═Al3++3H2O,故C错误;
D.过量CO2通入漂白粉溶液中生成次氯酸和碳酸氢钙,CO2+H2O+ClO-═HCO3-+HClO,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,明确在离子反应中哪些物质应保留化学式及反应的实质是解答本题的关键,注意过量反应产物的判断,题目难度不大.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
9.下列说法正确的是( )
| A. | 原电池是把电能转化成化学能的装置 | |
| B. | 原电池内部的阴离子向正极移动 | |
| C. | 原电池的两极分别发生氧化反应和还原反应 | |
| D. | 原电池中电子流出的一极是正极,发生氧化反应 |
10. 常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(稀溶液混合时体积可直接相加).下列判断错误的是( )
常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(稀溶液混合时体积可直接相加).下列判断错误的是( )
 常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(稀溶液混合时体积可直接相加).下列判断错误的是( )
常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(稀溶液混合时体积可直接相加).下列判断错误的是( )| A. | 由图中信息可知,HA一定是强酸 | |
| B. | 当V(MOH)=50.00 mL时,混合溶液中c(M+)+c(MOH)=0.01 mol•L-1 | |
| C. | N点对应的溶液中c(M+)=c(A-) | |
| D. | K点所对应的溶液中离子浓度大小关系为:c(M+)>c(A-)>c(OH-)>c(H+) |
1.以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是( )
| A. | He | B. |  | C. | 1s2 | D. | 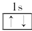 |
8. 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )| A. | 苛性钾溶液中KOH的质量是16.8 | |
| B. | 反应中转移电子0.21mol | |
| C. | 氯气被还原成0.06molClO-和0.03molClO3- | |
| D. | ClO3-的生成是由于温度升高引起的 |
5.下列物质间相互发生反应时:①Na+O2②Fe+O2③AgNO3溶液+氨水④HCOOH+Cu(OH)2 ⑤KI溶液+AgNO3溶液 ⑥ ⑦Na2CO3+C6H5COOH ⑧AlCl3+KOH ⑨P+Cl2⑩Cu+HNO3;在不同条件下得到不同产物的是( )
⑦Na2CO3+C6H5COOH ⑧AlCl3+KOH ⑨P+Cl2⑩Cu+HNO3;在不同条件下得到不同产物的是( )
 ⑦Na2CO3+C6H5COOH ⑧AlCl3+KOH ⑨P+Cl2⑩Cu+HNO3;在不同条件下得到不同产物的是( )
⑦Na2CO3+C6H5COOH ⑧AlCl3+KOH ⑨P+Cl2⑩Cu+HNO3;在不同条件下得到不同产物的是( )| A. | 除⑤ | B. | 除②⑤ | C. | 除④⑥ | D. | 除④⑤⑥ |
5. 二氧化碳被认为是加剧温室效应的主要物质,资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
二氧化碳被认为是加剧温室效应的主要物质,资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
Ⅰ.有科学家提出可利用FeO吸收和利用CO2,相关的热化学方程式如下:
6FeO(s)+CO2(g)═2Fe3O4(s)+C(s),△H=-76.0kJ•mol-1
②3FeO(s)+H2O(g)═Fe3O4(s)+H2(g)△H=-18.7kJ•mol-1
(1)在上述反应中①中,每吸收1molCO2,就有4 molFeO被氧化.
(2)试写出C(s)与水蒸气反应生成CO2和H2的热化学方程式C(s)+2H2O(g)=CO2(g)+2H2(g)△H=+38.6kJ/mol
Ⅱ.一定条件下,二氧化碳转化为甲烷.向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应的反应CO2(g)+4H2(g)?CH4(g)+2H2O(g).达到平衡时,各物质的浓度分别为CO20.2mol•L-1、CH40.8mol•L-1、H20.8mol•L-1,H2O1.6mol•L-1
(3)在300℃是,将各物质按下列起始浓度(mol•L-1)加入该反应容器中,达到平衡后,各组分浓度与上述题中描述的平衡浓度相同的是A、D.
(4)若保持温度不变,再向该容器内充入与起始量相等的CO2和H2,重新达到平衡时,CH4的浓度D (填字母).
A.c(CH4)=0.8mol•L-1 B.0.8mol•L-1>c(CH4)>1.6mol•L-1
C.c(CH4)=l.6mol•L-1 D.C(CH4)>1.6mol•L-1
(5)在300℃时,如果向该容器中加入CO20.8mol•L-1、H21.0mol•L-1、CH4 2.8mol•L-1、H2O 2.0mol•L-1,则该可逆反应初始时叫v正> v逆 (填“>”或“<”).
(6)若已知200℃时该反应的平衡常数K=64.8 则该反应的△H< 0(填“>”或“<”).
Ⅲ.某高校的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示
(7)上述电解反应在温度小于900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融合碳酸钙,阴极的电极反应式为3CO2+4e-═C+2CO32-,则阳极的电极反应式为2CO32--4e-=2CO2↑+O2↑.
 二氧化碳被认为是加剧温室效应的主要物质,资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
二氧化碳被认为是加剧温室效应的主要物质,资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.Ⅰ.有科学家提出可利用FeO吸收和利用CO2,相关的热化学方程式如下:
6FeO(s)+CO2(g)═2Fe3O4(s)+C(s),△H=-76.0kJ•mol-1
②3FeO(s)+H2O(g)═Fe3O4(s)+H2(g)△H=-18.7kJ•mol-1
(1)在上述反应中①中,每吸收1molCO2,就有4 molFeO被氧化.
(2)试写出C(s)与水蒸气反应生成CO2和H2的热化学方程式C(s)+2H2O(g)=CO2(g)+2H2(g)△H=+38.6kJ/mol
Ⅱ.一定条件下,二氧化碳转化为甲烷.向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应的反应CO2(g)+4H2(g)?CH4(g)+2H2O(g).达到平衡时,各物质的浓度分别为CO20.2mol•L-1、CH40.8mol•L-1、H20.8mol•L-1,H2O1.6mol•L-1
(3)在300℃是,将各物质按下列起始浓度(mol•L-1)加入该反应容器中,达到平衡后,各组分浓度与上述题中描述的平衡浓度相同的是A、D.
| 选项 | CO | H2 | CH4 | H2O |
| A | 0 | 0 | 1 | 2 |
| B | 2 | 8 | 0 | 0 |
| C | 1 | 4 | 1 | .2 |
| D | 0.5 | 2 | 0.5 | 1 |
A.c(CH4)=0.8mol•L-1 B.0.8mol•L-1>c(CH4)>1.6mol•L-1
C.c(CH4)=l.6mol•L-1 D.C(CH4)>1.6mol•L-1
(5)在300℃时,如果向该容器中加入CO20.8mol•L-1、H21.0mol•L-1、CH4 2.8mol•L-1、H2O 2.0mol•L-1,则该可逆反应初始时叫v正> v逆 (填“>”或“<”).
(6)若已知200℃时该反应的平衡常数K=64.8 则该反应的△H< 0(填“>”或“<”).
Ⅲ.某高校的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示
(7)上述电解反应在温度小于900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融合碳酸钙,阴极的电极反应式为3CO2+4e-═C+2CO32-,则阳极的电极反应式为2CO32--4e-=2CO2↑+O2↑.

 .
.