题目内容
7.NA为阿伏加德罗常数,下列说的是( )| A. | 2.24LCO2中含0.3NA原子 | |
| B. | 0.3molNH4NO3固体中含0.3NANH4+ | |
| C. | 5.6g铁粉完全反应一定失去0.3NA电子 | |
| D. | 25℃,0.1NAHCl气体溶于1L水,溶液pH=1 |
分析 A.CO2所处的状态不明确;
B.1个NH4NO3固体中含1个铵根离子和1个硝酸根离子;
C.铁被硝酸氧化一定是得到三价铁,但铁过量时会把三价铁还原为二价铁分析判断;
D.25℃,0.1NAHCl气体溶于1L水,溶液体积大于1L.
解答 解:A.CO2所处的状态不明确,故其物质的量和原子个数无法计算,故A错误;
B.1个NH4NO3固体中含1个铵根离子和1个硝酸根离子,0.3molNH4NO3固体中含0.3NANH4+,故B正确;
C..6g铁物质的量为0.1mol,与过量的硝酸反应一定生成三价铁离子,电子转移为0.3mol,若铁过量,铁会和三价铁离子反应生成亚铁离子,电子转移为0.2mol,故C错误;
D.25℃,0.1NAHCl气体物质的量为0.1mol,溶于1L水,溶液体积大于1L,氢离子浓度小于0.1mol/L,故溶液PH不是1,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,题目难度中等.

练习册系列答案
相关题目
18.设NA代表阿伏加德罗常数的数值.下列有关叙述正确的是( )
①标准状况下,2.24LH2O含有的分子数等于0.1NA
②23gNa在氧气中完全氧化失电子数一定为NA
③1mol硫酸钾中阴离子所带电荷数为NA
④常温常压下,32gO2或O3中所含电子数为16NA
⑤由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA.
①标准状况下,2.24LH2O含有的分子数等于0.1NA
②23gNa在氧气中完全氧化失电子数一定为NA
③1mol硫酸钾中阴离子所带电荷数为NA
④常温常压下,32gO2或O3中所含电子数为16NA
⑤由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA.
| A. | ①②⑤ | B. | ②③⑤ | C. | ③④⑤ | D. | ②④⑤ |
12.如图所示三个烧瓶中分别装人含酚酞的0.01mol/LCH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质.则下列叙述正确的是( )

| A. | ①说明水解反应为放热反应 | B. | ③说明水解反应为吸热反应 | ||
| C. | ①中溶液红色变浅 | D. | ③中溶液红色变深 |
19.氢氧化铁悬浊液与氢氧化铁具有的共同性质是( )
| A. | 分散质颗粒直径都在1nm~100 nm之间 | |
| B. | 能透过半透膜 | |
| C. | 都有丁达尔效应 | |
| D. | 呈红褐色 |
16.下列离子方程式的书写正确的是( )
| A. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 氯气通入NaOH溶液中:2OH-+Cl2═Cl-+ClO-+H2O | |
| C. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | AlC13溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
18.自然界的CaF2又称萤石,是一种难溶于水的困难,属于典型的离子晶体.下列一定能说明CaF2是离子晶体的实验是( )
| A. | CaF2难溶于水,其水溶液的导电性极弱 | |
| B. | CaF2的熔、沸点较高,硬度较大 | |
| C. | CaF2固体不导电,但在熔融状态下可以导电 | |
| D. | CaF2在有机溶剂(如苯)中的溶解度极小 |


 ,反应类型:消去反应;
,反应类型:消去反应;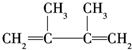 +Br2→CH2BrCBr(CH3)(CH3)C=CH2,反应类型:加成反应.
+Br2→CH2BrCBr(CH3)(CH3)C=CH2,反应类型:加成反应.