题目内容
18.已知氧化性Br2>Fe3+.FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:a Fe2++b Br-+c Cl2→d Fe3++e Br2+f Cl-.下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )
| A. | 2 4 3 2 2 6 | B. | 0 2 1 0 1 2 | ||
| C. | 2 0 1 2 0 2 | D. | 2 2 2 2 1 4 |
分析 二价铁离子还原性强于溴离子,溴化亚铁溶液中通入氯气,先氧化二价铁离子,剩余的氯气再氧化溴离子,结合2Fe2+~Cl2,2Br-~Cl2,根据氯气和FeBr2反应的离子方程式确定a、b、c、d、e、f是否符合反应实际,
A.2Fe2++4Br-+3Cl2→2Fe3++2Br2+6Cl-,二价铁离子、溴离子都被氧化,氯气足量时可以发生;
B.0Fe2++2Br-+Cl2→0Fe3++Br2+2Cl-,氯气只氧化溴离子,不氧化二价铁离子;
C.2Fe2++0Br-+Cl2→2Fe3++0Br2+2Cl-,氯气不足时,只氧化二价铁离子;
D.2Fe2++2Br-+2Cl2→2Fe3++1Br2+4Cl-,氯气不足,把亚铁离子氧化成三价铁离子后,再部分氧化溴离子.
解答 解:A.溴化亚铁溶液中通入足量的氯气,二价铁离子、溴离子都被氧化,离子方程式:2Fe2++4Br-+3Cl2→2Fe3++2Br2+6Cl-,故A正确;
B.二价铁离子还原性强于溴离子,氯气少量先氧化二价铁离子,所以不可能只氧化溴离子不氧化二价铁离子,故B错误;
C.溴化亚铁溶液中通入很少量的氯气,氯气不足只氧化二价铁离子,不氧化溴离子,离子方程式:2Fe2++Cl2═2Fe3++2Cl-,故C正确;
D.当加入的氯气把Fe2+完全氧化成Fe3+,还有部分剩余时,可以发生反应2Fe2++2Br-+2Cl2→2Fe3++1Br2+4Cl-,故D正确;
故选:B.
点评 本题考查了氧化还原反应方程式的书写,明确氧化还原反应先后规律,熟悉二价铁离子与溴离子还原性强弱是解题关键,题目难度中等.

练习册系列答案
相关题目
9.将3mol A与3mol B混合于3L的密闭容器中,发生如下反应:2A(g)+3B(g)?2C(g)+nD(g),2s后达平衡A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断正确的是( )
| A. | v(B)=0.25 mol•L-1•s-1 | B. | C的体积分数为30% | ||
| C. | B的转化率为25% | D. | n=2 |
10.下列离子方程式中,正确的是( )
| A. | 铁粉与氯化铁溶液混合:Fe+Fe3+=2Fe2+ | |
| B. | 氯化铝溶液与氨水反应:Al3++3OH-=Al(OH)3↓ | |
| C. | 碳酸钙与稀盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 醋酸与氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O |
8.有关Na2CO3和NaHCO3的叙述中正确的是( )
| A. | 相同温度下,Na2CO3的溶解度大于NaHCO3 | |
| B. | NaHCO3比Na2CO3热稳定性强 | |
| C. | Na2CO3和NaHCO3均可与澄清石灰水反应 | |
| D. | Na2CO3和NaHCO3均不与NaOH溶液反应 |
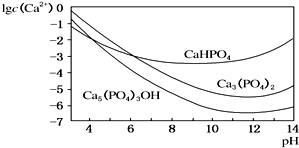 羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,其常用的制备方法有两种:
羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,其常用的制备方法有两种: 含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料.现有一块已知质量为m1g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料.现有一块已知质量为m1g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案: (1)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示.
(1)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示. 将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L.
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L.