题目内容
11.下列对氢氧化铁胶体性质的叙述不正确的是( )| A. | 能产生电泳现象 | B. | 能产生丁达尔现象 | ||
| C. | 不能通过滤纸 | D. | 氢氧化铁胶体粒子带正电荷 |
分析 胶体的性质有:能产生电泳现象;能产生丁达尔现象;能通过滤纸;胶体微粒带有电荷.
解答 解:A.胶体微粒带有电荷,所以能产生电泳现象,故A正确;
B.胶体的微粒直径在1-100nm之间,所以能产生丁达尔现象,故B正确;
C.胶体的微粒直径在1-100nm之间,能通过滤纸但不能通过半透膜,故C错误;
D.胶体本身不带电荷,但胶粒具有吸附性,吸附离子致使胶体微粒带有电荷,故D正确.
故选C.
点评 本题考查了胶体的性质,难度不大,根据教材基础知识解答,要注意D选项,胶体本身不带电荷,但胶体具有吸附性,吸附离子致使胶体微粒带有电荷.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
19.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,18gH2O中所含的质子数为10NA | |
| B. | 标准状况下,11.2LO2参加反应转移的电子数一定为2 NA | |
| C. | 28gN2和CO的混合气体中含有的分子数为NA | |
| D. | 5.6g铁与过量稀硫酸反应失去电子数为0.3 NA |
16.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 元素A、B组成的化合物常温下不一定呈气态 | |
| B. | 元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | 化合物AE与CE含有相同类型的化学键 | |
| D. | 工业上常用电解法电解熔融的DE3制备元素D的单质 |
3.已知含有电解质的凝胶具有导电性,铝镍胶体电池是一种正在开发的二次高能电池,放电时总反应为2Al+3Ni2O3+9H2O═2Al(OH)3+6Ni(OH)2.下列有关该电池的说法正确的是( )
| A. | 此电池的正极为Ni2O3,电池中的凝胶呈弱酸性 | |
| B. | 放电时,负极反应式为Al+3H2O-3e-═Al(OH)3+3H+ | |
| C. | 电池充电过程中,阳极附近溶液的pH升高 | |
| D. | 充电时,外接直流电源负极与铝镍胶体电池铝电极相连 |
1.下列方程式表示电离平衡的是( )
| A. | 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) | B. | H2O+H2O=H3O++OH- | ||
| C. | NH3.H2O(aq)=NH3(g)+H2O(1) | D. | Cl2+H2O=H++Cl-+HClO |
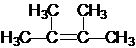 ;
; .
. .
.